题目内容
8.下列说法正确的是( )| A. | NaHSO3和NaHCO3的混合溶液中(S和C均用R表示):c(Na+)+c(H+)=c(HRO3-)+c(RO32-)+c(OH-) | |
| B. | 常温下物质的量浓度相等的①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中水的电离程度:③>①>② | |
| C. |  常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-)与pH值的关系如图所示,当pH=4.5溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-) | |
| D. | 冰醋酸中逐滴加水,溶液的导电性、醋酸的电离程度、pH均先增大后减小 |
分析 A.溶液中电荷守恒分析;
B.①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中铵根离子水解受阴离子影响,①中碳酸根离子水解促进铵根离子水解,②中硫酸根离子不影响铵根离子水解,③亚铁离子水解显酸性抑制铵根离子水解;
C.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-),PH增大醋酸减小,醋酸根离子增多,当pH=4.5溶液中c(CH3COOH)>c(CH3COO-),c(H+)>c(OH-);
D.冰醋酸中逐滴加水醋酸电离程度增大,溶液的导电性、pH与溶液中溶液中的离子浓度有关.
解答 解:A.溶液中存在电荷守恒为:c(Na+)+c(H+)=c(HRO3-)+2c(RO32-)+c(OH-),故A错误;
B..①(NH4)2CO3、②(NH4)2SO4、③(NH4)2Fe(SO4)2三种溶液中铵根离子水解受阴离子影响,①中碳酸根离子水解促进铵根离子水解,②中硫酸根离子不影响铵根离子水解,③亚铁离子水解显酸性抑制铵根离子水解,水的电离程度①>②>③,故B错误;
C.常温下醋酸和醋酸钠混合溶液中c(CH3COOH)、c(CH3COO-),PH增大醋酸减小,醋酸根离子增多,PH=4.75时c(CH3COOH)=c(CH3COO-),当pH=4.5溶液中c(CH3COOH)>c(CH3COO-),c(H+)>c(OH-),故C正确;
D.冰醋酸中逐滴加水,溶液中的氢离子浓度先增大后逐渐减小,PH先减小后增大,导电能力先增大后逐渐减弱,但醋酸的电离程度逐渐增大,故D错误;
故选C.
点评 本题考查了电解质溶液中离子浓度大小、电荷守恒分析、图象变化的理解应用、弱电解质电离平衡影响因素等知识点,掌握基础是解题关键,题目难度中等.

 全能测控期末小状元系列答案
全能测控期末小状元系列答案| A. | 6.02×1023 就是阿佛加德罗常数 | |
| B. | 1 摩尔氢气含有2NA个氢原子 | |
| C. | 1 摩尔任何物质都含有6.02×1023 个分子 | |
| D. | 1 摩尔水含有18×6.02×1023 个分子 |
| A. | CH3COOH | B. | Br2 | C. | SO2 | D. | NH4HCO3 |
| A. | 120° | B. | 104°30′ | C. | 109°28′ | D. | 60° |
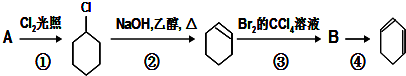
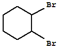 ;
; +Cl2 $\stackrel{光照}{→}$
+Cl2 $\stackrel{光照}{→}$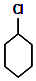 +HCl.
+HCl.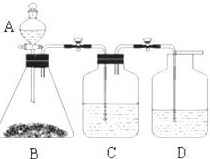 为了确定醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱,有人设计了如图所示的装置进行实验:
为了确定醋酸溶液、二氧化碳水溶液、苯酚溶液的酸性强弱,有人设计了如图所示的装置进行实验: