题目内容
4.已知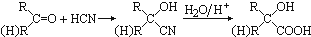 ,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成:
,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成: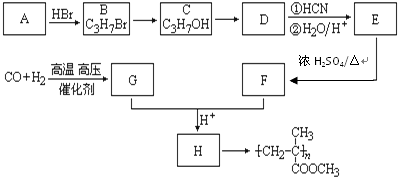
(1)A、E的结构简式分别为:CH2=CHCH3、
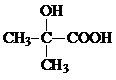 ;
;(2)B→C、E→F的反应类型分别为:水解或取代反应、消去反应;
(3)写出下列转化的化学方程式:
C→D
 ;
;G+F→H
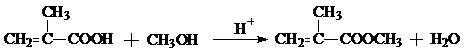 ;
;(4)要检验B中的Br元素,可用的操作和现象为取少量B加入NaOH溶液,充分振荡,静置,取上层清液,加入适量稀硝酸,再加入硝酸银溶液,若产生浅黄色沉淀,则证明有Br元素.
(5)写出符合下列要求的H的同分异构体①有一个支链②能使溴的四氯化碳溶液褪色③跟NaHCO3反应生成CO2(CH3)2C=CHCOOH,CH2=C(CH3)CH2COOH.(只要求写出2个)
分析 由有机玻璃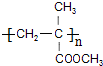 的结构可知,H发生加聚反应得到有机玻璃,故H为CH2=C(CH3)COOCH3,CO和H2按物质的量之比1:2可以制得G,G与F反应得到H,故G为CH3OH,F为CH2=C(CH3)COOH,D与HCN发生信息中反应生成E,E中羟基与羧基连接同一碳原子上,故E为
的结构可知,H发生加聚反应得到有机玻璃,故H为CH2=C(CH3)COOCH3,CO和H2按物质的量之比1:2可以制得G,G与F反应得到H,故G为CH3OH,F为CH2=C(CH3)COOH,D与HCN发生信息中反应生成E,E中羟基与羧基连接同一碳原子上,故E为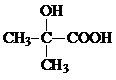
 ,C为
,C为 ,B为CH3CH(Br)CH3,A为CH2=CHCH3,据此分析解答.
,B为CH3CH(Br)CH3,A为CH2=CHCH3,据此分析解答.
解答 解:由有机玻璃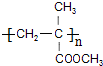 的结构可知,H发生加聚反应得到有机玻璃,故H为CH2=C(CH3)COOCH3,CO和H2按物质的量之比1:2可以制得G,G与F反应得到H,故G为CH3OH,F为CH2=C(CH3)COOH,D与HCN发生信息中反应生成E,E中羟基与羧基连接同一碳原子上,故E为
的结构可知,H发生加聚反应得到有机玻璃,故H为CH2=C(CH3)COOCH3,CO和H2按物质的量之比1:2可以制得G,G与F反应得到H,故G为CH3OH,F为CH2=C(CH3)COOH,D与HCN发生信息中反应生成E,E中羟基与羧基连接同一碳原子上,故E为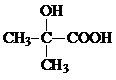
 ,C为
,C为 ,B为CH3CH(Br)CH3,A为CH2=CHCH3,
,B为CH3CH(Br)CH3,A为CH2=CHCH3,
(1)通过以上分析知,A、E结构简式分别为CH2=CHCH3、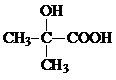

(2)B→C是卤代烃的水解反应,也属于取代反应,E→F醇发生的消去反应,故答案为:水解反应或取代反应;消去反应;
(3)C→D是2-丙醇生催化氧化生成丙酮,反应方程式为: ;
;
G+F→H是羧酸与醇发生的酯化反应,反应方程式为:
故答案为: ;
;
(4)要检验B中的Br元素,可用的操作和现象为:取少量B加入NaOH溶液,充分振荡,静置,取上层清液,加入适量稀硝酸,再加入硝酸银溶液,若产生浅黄色沉淀,则证明有Br元素,
故答案为:取少量B加入NaOH溶液,充分振荡,静置,取上层清液,加入适量稀硝酸,再加入硝酸银溶液,若产生浅黄色沉淀,则证明有Br;
(5)H为CH2=C(CH3)COOCH3,符合下列要求的同分异构体①有一个支链②能使溴的四氯化碳溶液褪色③跟NaHCO3反应生成CO2,含有羧基与碳碳双键,符合条件的同分异构体有:(CH3)2C=CHCOOH,CH2=C(CH3)CH2COOH等,故答案为:(CH3)2C=CHCOOH;CH2=C(CH3)CH2COOH.
点评 本题考查有机物推断,为高频考点,侧重考查学生分析判断及知识综合应用能力,根据产物结构简式、某些物质分子式结合反应条件采用正逆结合的方法进行推断,正确判断各物质结构简式是解本题关键,难点是同分异构体种类判断,题目难度中等.

| A. | v(正)增大,v(逆)减小 | B. | v(正)减小,v(逆)增大 | ||
| C. | v(正)、v(逆)不同程度增大 | D. | v(正)、v(逆)同等程度增大 |
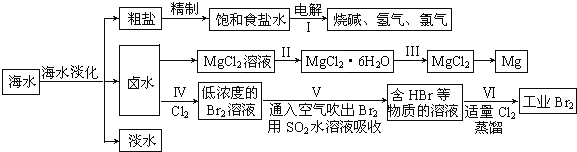
(一)某化学研究小组用图装置模拟步骤I电解食盐水(用铁和石墨做电极).
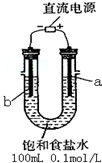
(1)a电极材料是石墨(填铁、石墨),其电极反应式为2Cl--2e-=Cl2↑.
(2)当阴极产生11.2mL气体时(标准状况),该溶液的pH为12(忽略反应前后溶液体积的变化).
(二)卤水中蕴含着丰富的镁资源,就MgCl2粗产品的提纯、镁的冶炼过程回答:已知MgCl2粗产品的溶液中含有Fe2+、Fe3+和Al3+.
下表是生成氢氧化物沉淀的pH:
| 物质 | Fe(OH)3 | Fe(OH)2 | Al(OH)3 | Mg(OH)2 |
| 开始沉淀pH | 2.7 | 8.1 | 3.8 | 9.5 |
| 完全沉淀pH | 3.7 | 9.6 | 4.8 | 11.0 |
a.Cl2b.NaOH c.MgO d.H2O2 e.MgCO3
(4)步骤Ⅱ由MgCl2溶液获得MgCl2•6H2O的操作是:应在氯化氢气流中失水获得氯化镁晶体.
(5)海水经过处理后可以得到无水氯化镁,无水氯化镁是工业制取镁的原料.试写出电解熔融氯化镁制取金属镁的化学反应方程式MgCl2$\frac{\underline{\;通电\;}}{\;}$Mg+Cl2↑.
(6)某化工厂生产过程中会产生含有Cu2+和Pb2+的污水.排放前拟用沉淀法除去这两种离子,根据下列数据,你认为投入Na2S(选填“Na2S”或“NaOH”)效果更好.
| 难溶电解质 | Cu(OH)2 | CuS | Pb(OH)2 | PbS |
| Ksp | 4.8×10-20 | 6.3×10-36 | 1.2×10-15 | 1.0×10-28 |
(7)步骤Ⅳ中已获得Br2,步骤Ⅴ中又将Br2还原为Br-,其目的是富集溴元素.
(8)写出步骤Ⅴ用SO2水溶液吸收Br2的离子方程式:Br2+SO2+2H2O=4H++SO42-+2Br-.
| A. | Na+、H+、Cl-、SO42- | B. | Na+、H+、Cl-、HCO3- | ||
| C. | Al3+、K+、OH-、NO3- | D. | NH4+、OH-、NO3-、Na+ |
| A. | 红棕色的NO2加压后颜色先变深后变浅 | |
| B. | 钢铁在潮湿的空气中容易生锈 | |
| C. | 温度过高对合成氨不利 | |
| D. | 常温下,将1mLpH=3的醋酸溶液加水稀释至l00mL,测得其pH<5 |
| A. | CO(g) 与Na2O2(s)反应放出509kJ热量时,电子转移数为6.02×1023 | |
| B. | 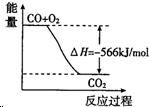 图可表示由CO生成CO2的反应过程和能量关系 | |
| C. | 2Na2O2(s)+2CO2(s)═2Na2CO3(s)+O2(g)△H>-452kJ/mol | |
| D. | CO的燃烧热为283kJ |
| A. | 烷烃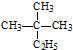 的系统命名为2-甲基-2-乙基丙烷 的系统命名为2-甲基-2-乙基丙烷 | |
| B. | 由石油分馏可以获得石蜡,由石蜡裂化可获得乙烯 | |
| C. | 图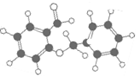 所示的有机物分子式为C14H12O2,能发生银镜反应 所示的有机物分子式为C14H12O2,能发生银镜反应 | |
| D. | 在稀硫酸溶液中,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH |
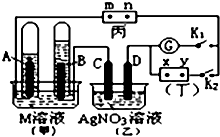 如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题:
如图所示的实验装置,丙为用淀粉碘化钾和酚酞混合溶液润湿的滤纸,m、n为夹在滤纸两端的铂夹.丁为直流电源,x、y为电源的两极.G为电流计,电极均为石墨电极.闭合K2、断开K1,一段时间后,A、B两极产生的气体体积之比为2:1,回答下列问题: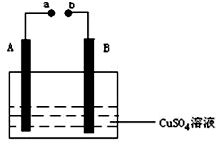 如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则:
如图所示装置为在直流电的作用下电解CuSO4溶液图,其中A、B为石墨电极,a、b为电源的两极,当接通电源后,通电一段时间后,将B电极取出洗干净并干燥后称量其质量增加了3.2g,则: