题目内容
4.可逆反应2SO2(g)+O2(g)?2SO3(g)(正反应为放热反应),升高温度对该反应产生的影响是( )| A. | v(正)增大,v(逆)减小 | B. | v(正)减小,v(逆)增大 | ||
| C. | v(正)、v(逆)不同程度增大 | D. | v(正)、v(逆)同等程度增大 |
分析 升高温度,正逆化学反应速率都加快;
升高温度,化学平衡向着吸热方向进行,但是增加程度不一样,正逆反应速率不相等.
解答 解:A、升高温度,正逆化学反应速率都加快,即v正增大,v逆 增大,故A错误;
B、升高温度,正逆化学反应速率都加快,即v正增大,v逆 增大,故B错误;
C、升高温度,化学平衡向着吸热方向进行,即向着逆方向进行,正反应速率小于逆反应速率,即逆反应速率增加的程度大,故C正确;
D、升高温度,化学平衡向着吸热方向进行,但是增加程度不一样,故D错误;
故选C.
点评 本题考查温度对化学反应速率和化学平衡移动的影响知识,注意知识的迁移和应用是关键,难度不大.

练习册系列答案
相关题目
14.A、B、C、D为四种短周期主族元素,且原子序数依次增大.已知A的最外层电子数是其电子层数的2倍,B是地壳中含量最高的元素,B原子的最外层电子数是D原子最外层电子数的2倍,C原子最外层只有一个电子.下列说法正确的是( )
| A. | 原子半径:C>A | |
| B. | 气态氢化物的稳定性:A>B | |
| C. | 最髙价氧化物对应水化物的碱性:C<D | |
| D. | 元素C、D的最高价氧化物对应的水化物之间不能发生反应 |
15.下列说法错误的是( )
| A. | 硅是良好的半导体材料 | |
| B. | 氨气与硝酸合成氮肥属于人工固氮 | |
| C. | 金刚石、石墨和富勒烯互为同素异形体 | |
| D. | 硬铝、青铜和不锈钢都属于合金 |
19.等物质的量浓度、等体积的下列溶液中:①H2CO3 ②Na2CO3 ③NaHCO3 ④NH4HCO3 ⑤(NH4)2CO3.下列关系或者说法错误的是( )
| A. | c(CO32-)的大小关系为:②>⑤>③>④>① | |
| B. | 将溶液蒸干灼烧只有②能得到对应的固体物质 | |
| C. | ③④⑤既能与盐酸反应,又能与NaOH溶液反应 | |
| D. | c(HCO3-)的大小关系为:④>③>⑤>②>① |
3.FeBr2是一种黄绿色鳞片状的固体,某研究性学习小组为了探究它的还原性,进行了如下实验:
I.实验需要90mL 0.10mol•L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是玻璃棒、100mL容量瓶.
(2)下列有关配制过程中说法错误的是abde(填序号).
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色.某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+.
(3)请你完成下表,验证假设
若假设1正确,从实验①分离出Br2的实验操作名称是萃取和分液
(4)若在50mL上述FeBr2溶液通入标准状况下112mL Cl2,反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
I.实验需要90mL 0.10mol•L-1FeBr2溶液
(1)配制FeBr2溶液除烧杯、量筒、胶头滴管外还需的玻璃仪器是玻璃棒、100mL容量瓶.
(2)下列有关配制过程中说法错误的是abde(填序号).
a.用托盘天平称量质量为1.944g的FeBr2
b.将称量的FeBr2放入容量瓶中,加90mL蒸馏水溶解
c.洗涤溶解FeBr2的烧杯,并将洗涤液转移至容量瓶中
d.容量瓶贴签存放配好的FeBr2溶液
e.定容时,仰视容量瓶刻度线会使配制的FeBr2溶液浓度偏高
II.探究FeBr2的还原性
取10mL上述FeBr2溶液,向其中滴加少量新制的氯水,振荡后溶液呈黄色.某同学对产生黄色的原因提出了假设:
假设1:Br-被Cl2氧化成Br2溶解在溶液中;
假设2:Fe2+被Cl2氧化成Fe3+.
(3)请你完成下表,验证假设
| 实验步骤、预期现象 | 结论 |
| ①向溶液中加入四氯化碳,操作振荡、静置, 现象CCl4层呈橙红色,水层呈无色 | 假设1正确 |
| ②向溶液中另入KSCN溶液, 现象溶液变为红色 | 假设2正确 |
(4)若在50mL上述FeBr2溶液通入标准状况下112mL Cl2,反应的离子方程式为2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl-.
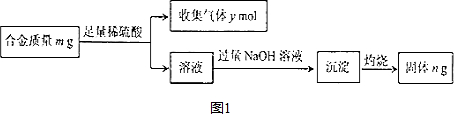
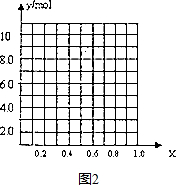


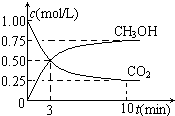 随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.
随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视.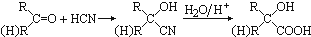 ,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成:
,CO和H2按物质的量之比1:2可以制得G,有机玻璃可按下列路线合成: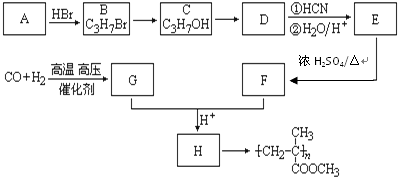
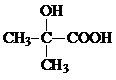 ;
; ;
;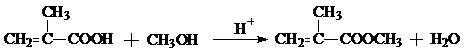 ;
;