题目内容
18.已知金属活动相差越大,形成原电池时越容易放电.请根据如图装置回答问题: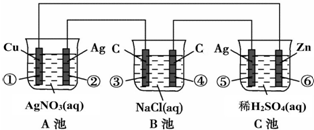
(1)A、B、C三个装置中作为原电池的是C.
(2)写出下列电极上发生的反应:
②极Ag-e-=Ag+,
⑥极Zn-2e-=Zn2+.
(3)当电路上有1mol电子流过时:①极上质量变化增加108g,⑥极上质量变化减少32.5g.
(4)一段时间后溶液中pH值的变化:A不变,B增大,C增大.(填增大、减小或不变)
分析 (1)C是能自发进行的氧化还原反应,且符合原电池的构成条件,所以属于原电池,A、B有外接电源,属于电解池;
(2)A电解池中,Ag作阳极,阳极Ag失去电子发生氧化反应,C原电池中,Zn为负极失去电子生成锌离子;
(3)①银离子得到电子生成银,⑥锌失去电子生成锌离子,据此进行计算电极的质量变化;
(4)A池为铜上镀银,失去电子的银单质与得到电子产生的银单质一样多,pH不变;B池为电解氯化钠溶液,生成氢氧化钠、氯气和氢气,氢氧根离子浓度增大,pH增大;C池锌与稀硫酸反应生成硫酸锌和氢气,氢离子浓度减小,pH增大.
解答 解:(1)C是能自发进行的氧化还原反应,且符合原电池的构成条件,所以属于原电池,B有外接电源,属于电解池,A为电解池或电镀池,
故答案为:C;
(2)②为电解池的阳极,Ag失去电子生成银离子,电极方程式为:Ag++e-=Ag,
C为原电池,Zn为负极,反应中失去电子生成锌离子,电极方程式为Zn-2e-=Zn2+,
故答案为:Ag++e-=Ag;Zn-2e-=Zn2+;
(3)当电路上有1mol电子流过时,
①中铜电极上银离子得电子析出单质银,电极反应式为:Ag++e-=Ag,当电路上有1mol电子流过时析出银的质量为:1mol×108g/mol=108g;
⑥锌被氧化,电极反应式为:Zn-2e-=Zn2+,当电路上有1mol电子流过时,锌减少的质量为$\frac{1mol}{2}$×65g/mol=32.5g,
故答案为:增加108;减少32.5;
(4)A池为铜上镀银,失去电子的银单质与得到电子产生的银单质一样多,pH不变;B池为电解氯化钠溶液,生成氢氧化钠、氯气和氢气,氢氧根离子浓度增大,pH增大;C池锌与稀硫酸反应生成硫酸锌和氢气,氢离子浓度减小,pH增大,
故答案为:不变;增大;增大.
点评 本题考查了原电池和电解池原理的综合应用,题目难度中等,正确判断原电池和电解池是解本题关键,电极反应式的书写是学习难点,注意掌握电解池和原电池工作原理.

| A. | 2:3 | B. | 1:2 | C. | 3:4 | D. | 4:5 |
| A. | H2SO4(稀) | B. | CuSO4 | C. | FeCl3 | D. | FeCl2 |
| A. | 小苏打 | B. | 熟石灰 | C. | 生石灰 | D. | 纯碱 |
| 阳离子 | K+、Na+、Fe2+、Ba2+、NH4+、Ca2+ |
| 阴离子 | OH-、NO3-、I-、HCO3-、AlO2-、HSO4- |
①B的化学式为Ba(OH)2.
②A、B溶液混合加热反应的离子方程式H++SO42-+NH4++Ba2++2OH-$\frac{\underline{\;\;△\;\;}}{\;}$BaSO4↓+NH3↑+2H2O.
(2)若A的水溶液呈浅绿色,B的水溶液无色且其焰色反应为黄色.向A的水溶液中加入稀盐酸无明显现象,再加入B后溶液变黄,但A、B的水溶液混合亦无明显变化.则
①A的化学式为FeI2.
②经分析上述过程中溶液变黄的原因可能有两种(用离子方程式表示)
Ⅰ8H++2NO3-+6I-=2NO↑+3I2+4H2O;Ⅱ8H++2NO3-+6I-=2NO↑+3I2+4H2O和4H++NO3-+3Fe2+=NO↑+3Fe3++2H2O.
③请用一简易方法证明上述溶液变黄的原因取少量变黄溶液于试管中,滴加几滴KSCN溶液,若变红则Ⅱ合理(其他合理亦可).
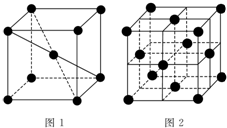 1 183K以下纯铁晶体的基本结构单元如图1所示,1 183K以上转变为图2所示结构的基本结构单元,在1中铁原子的配位数为8;其中为密堆积的是2(填“1”或“2”);1中的空间利用率为68%.
1 183K以下纯铁晶体的基本结构单元如图1所示,1 183K以上转变为图2所示结构的基本结构单元,在1中铁原子的配位数为8;其中为密堆积的是2(填“1”或“2”);1中的空间利用率为68%.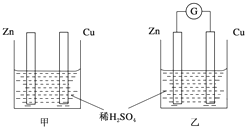 ①分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题:
①分别按图甲、乙所示装置进行实验,图中两个烧杯里的溶液为同浓度的稀硫酸,乙中G为电流计.请回答下列问题: