题目内容
10.三种弱酸HA,H2B,HC,电离常数为1.8×10-5,5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:①HA+HB-(少量)═A-+H2B;②H2B(少量)+C-═HB-+HC;③HA(少量)+C-═A-+HC.
若H2B的Ka1=4.3×10-7,则另两种酸对应的电离常数分别为(根据已知数据填空):HA的Ka=1.8×10-5,HC的Ka=4.9×10-10.
分析 酸性强的酸能制备酸性弱的酸,酸性越强,其电离常数越大,据此分析.
解答 解:①HA+HB-(少量)═A-+H2B,酸性:HA>H2B;
②H2B(少量)+C-═HB-+HC,酸性:H2B>HC>HB-;
③HA(少量)+C-═A-+HC,酸性:HA>HC;
综上可知,酸性:HA>H2B>HC>HB-,酸性越强,弱酸的电离平衡常数越大,所以HA的Ka为1.8×10-5,HC的Ka为4.9×10-10;
故答案为:1.8×10-5;4.9×10-10.
点评 本题考查了弱电解质的电离平衡常数、强酸制弱酸原理,题目难度不大,明确弱酸的电离平衡常数与酸性强弱的关系即可解答,侧重于考查学生对基本原理的理解和应用能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
20.某校化学兴趣小组采用酸碱中和滴定法测定学校新购入的烧碱的纯度(烧碱中含有不与酸反应的杂质),试根据实验回答.
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品.
②将样品配成250ml待测液.
③量取10.00ml待测液,注入锥形瓶中.
④在锥形瓶中滴入2~3滴酚酞,用0.2010mol/L的标准盐酸滴定待测烧碱溶液.
(2)该小组测得如表数据
根据如表数据,计算烧碱的纯度98%.
(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品.
②将样品配成250ml待测液.
③量取10.00ml待测液,注入锥形瓶中.
④在锥形瓶中滴入2~3滴酚酞,用0.2010mol/L的标准盐酸滴定待测烧碱溶液.
(2)该小组测得如表数据
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
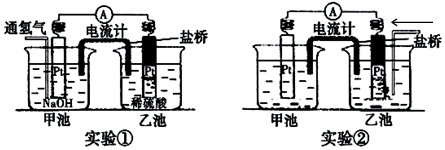
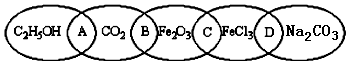
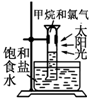
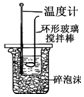
 .
.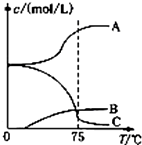 氯酸钠(NaClO3)是无机盐工业的重要产品之一.
氯酸钠(NaClO3)是无机盐工业的重要产品之一.