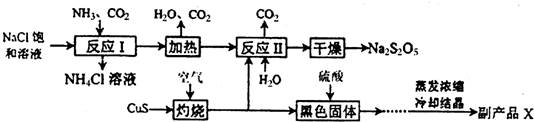
题目内容
20.某校化学兴趣小组采用酸碱中和滴定法测定学校新购入的烧碱的纯度(烧碱中含有不与酸反应的杂质),试根据实验回答.(1)实验步骤为:①用托盘天平准确称量4.1g烧碱样品.
②将样品配成250ml待测液.
③量取10.00ml待测液,注入锥形瓶中.
④在锥形瓶中滴入2~3滴酚酞,用0.2010mol/L的标准盐酸滴定待测烧碱溶液.
(2)该小组测得如表数据
| 滴定次数 | 待测液体积/ml | 标准盐酸体积/ml | |
| 滴定前读数/ml | 滴定后读数/ml | ||
| 第一次 | 10.00 | 0.20 | 22.90 |
| 第二次 | 10.00 | 0.50 | 20.40 |
| 第三次 | 10.00 | 4.00 | 24.10 |
| 第四次 | 10.00 | 0.00 | 20.00 |
分析 根据C(待测)=$\frac{C(标准)×V(标准)}{V(待测)}$计算,V(标准)用几次的平均值;根据m=cVM计算250mL烧碱样品中氢氧化钠的质量,再根据质量分数公式计算氢氧化钠的质量分数.
解答 解:第一次实验消耗的盐酸的体积偏大,舍去,则V(标准)=$\frac{19.90+20.10+20.00}{3}$=20.00mL,
c(待测)=$\frac{0.2010mol/L×0.0200L}{0.0100L}$=0.4020mol•L-1,
m=cVM=0.4020mol•L-1×0.25L×40g/mol=4.020g
ω(NaOH)=$\frac{4.020g}{4.10g}$×100%=98%,
故答案为:98%.
点评 本题考查了物质含量的测定,主要考查了溶液的配制、酸碱中和滴定的操作、数据处理和物质含量的计算等,题目难度不大,掌握中和滴定的原理是解题的关键.

练习册系列答案
 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案
相关题目
16.下列判断正确的是( )
| A. | pH=6的溶液一定呈酸性 | |
| B. | c(H+)水电离产生=c(OH-)水电离产生的溶液一定呈中性 | |
| C. | 使石蕊试液显红色的溶液一定呈酸性 | |
| D. | 强酸和强碱等物质的量混合后溶液一定呈中性 |
17.下列说法错误的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,屠呦呦对青蒿素的提取属于化学变化 | |
| B. | “熬胆矾铁釜,久之亦化为铜”,该过程发生了置换反应 | |
| C. | “霾尘积聚难见路人”,雾霾所形成的气溶胶有丁达尔效应 | |
| D. | 古剑“湛泸”“以剂钢为刃,剂钢指的是铁的合金 |
15.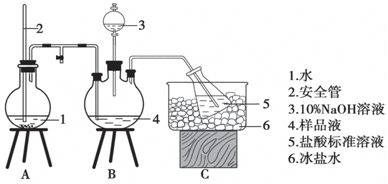 某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol•L-1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c2 mol•L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液.
②氯的测定
回答下列问题:
(1)装置中安全管的作用原理是使A瓶中压强稳定.
(2)用NaOH标准溶液滴定过剩的HCl时,应使用碱式滴定管,可使用的指示剂为酚酞或甲基橙.
(3)样品中氨的质量分数表达式为$\frac{(C{\;}_{1}V{\;}_{1}-C{\;}_{2}V{\;}_{2})×10{\;}^{-3}×17}{w}$×100%.
(4)测定氨前应该对装置进行气密性检查,若气密性不好测定结果将偏低(填“偏高”或“偏低”).
(5)氯的测定采用莫尔法,莫尔法是一种沉淀滴定法,用标准硝酸银溶液滴定,进行测定溶液中Cl-的浓度.已知:
①若用AgNO3溶液滴定待测液,可选为滴定指示剂的是C.
A.NaCl B.BaBr2 C.Na2CrO4 D.KSCN
②滴定终点的现象是滴入最后一滴标准溶液,生成砖红色沉淀,且30s 不复原.
 某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.
某小组以CoCl2•6H2O、NH4Cl、H2O2、浓氨水为原料,在活性炭催化下,合成了橙黄色晶体X.为确定其组成,进行如下实验.①氨的测定:精确称取w g X,加适量水溶解,注入如图所示的三颈瓶中,然后逐滴加入足量10%NaOH溶液,通入水蒸气,将样品液中的氨全部蒸出,用V1 mL c1 mol•L-1的盐酸标准溶液吸收.蒸氨结束后取下接收瓶,用c2 mol•L-1 NaOH标准溶液滴定过剩的HCl,到终点时消耗V2 mL NaOH溶液.
②氯的测定
回答下列问题:
(1)装置中安全管的作用原理是使A瓶中压强稳定.
(2)用NaOH标准溶液滴定过剩的HCl时,应使用碱式滴定管,可使用的指示剂为酚酞或甲基橙.
(3)样品中氨的质量分数表达式为$\frac{(C{\;}_{1}V{\;}_{1}-C{\;}_{2}V{\;}_{2})×10{\;}^{-3}×17}{w}$×100%.
(4)测定氨前应该对装置进行气密性检查,若气密性不好测定结果将偏低(填“偏高”或“偏低”).
(5)氯的测定采用莫尔法,莫尔法是一种沉淀滴定法,用标准硝酸银溶液滴定,进行测定溶液中Cl-的浓度.已知:
| 银盐 性质 | AgCl | AgBr | AgCN | Ag2CrO4 | AgSCN |
| 颜色 | 白 | 浅黄 | 白 | 砖红 | 白 |
| 溶解度(mol•L-1) | 1.3410-6 | 7.110-7 | 1.110-8 | 6.510-5 | 1.010-6 |
A.NaCl B.BaBr2 C.Na2CrO4 D.KSCN
②滴定终点的现象是滴入最后一滴标准溶液,生成砖红色沉淀,且30s 不复原.
9.某学生用NaOH标准溶液滴定未知浓度的盐酸,进行了如下实验:
取15.00mL待测溶液于250mL锥形瓶中,加入1~2滴酚酞试液,用NaOH标准溶液滴定.按上述操作方法再重复2次.
(1)填空:(①、②小题中选填“偏高”、“偏低”或“无影响”)
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则待测液的浓度偏高;
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响;
③滴定时边滴边摇动锥形瓶,眼睛应观察b(选填编号)
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成浅红色.
(2)滴定结果如表所示:
若NaOH标准溶液的浓度为0.1010mol/L,则该待测液的浓度为0.1347mol/L.
取15.00mL待测溶液于250mL锥形瓶中,加入1~2滴酚酞试液,用NaOH标准溶液滴定.按上述操作方法再重复2次.
(1)填空:(①、②小题中选填“偏高”、“偏低”或“无影响”)
①碱式滴定管用蒸馏水洗涤后,直接加入NaOH标准溶液进行滴定,则待测液的浓度偏高;
②锥形瓶用蒸馏水洗涤后,水未倒尽,则滴定时用去NaOH标准溶液的体积无影响;
③滴定时边滴边摇动锥形瓶,眼睛应观察b(选填编号)
a.滴定管内液面的变化 b.锥形瓶内溶液颜色的变化
④滴定达到终点时,酚酞指示剂由无色变成浅红色.
(2)滴定结果如表所示:
| 滴定次数 | 标准溶液的体积/mL | 待测盐酸溶液的体积/mL | |
| 滴定前刻度 | 滴定后刻度 | ||
| 1 | 1.05 | 21.10 | 15.00 |
| 2 | 2.00 | 21.95 | 15.00 |