题目内容
2.下列实验装置或操作合理的是( )| A | B | C | D |
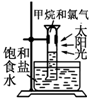 | 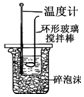 | 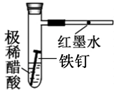 | 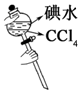 |
| CH4的取代反应 | 中和热的测定 | 验证铁的电化学腐蚀类型 | 采用CCl4萃取I2 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.光照下甲烷与氯气发生取代反应生成HCl,HCl极易溶于水;
B.温度计测定温度,环形玻璃搅拌棒可搅拌,泡沫可隔热,温度计的位置不合理;
C.不构成原电池,酸与Fe反应生成氢气;
D.四氯化碳可萃取碘,上下颠倒可混合.
解答 解:A.光照下甲烷与氯气发生取代反应生成HCl,HCl极易溶于水,则量筒中液面上升可验证CH4的取代反应,故A正确;
B.温度计测定温度,环形玻璃搅拌棒可搅拌,泡沫可隔热,温度计应在搅拌棒的中央,图中的实验装置不合理,故B错误;
C.不构成原电池,酸与Fe反应生成氢气,可利用生铁代替铁验证,故C错误;
D.四氯化碳可萃取碘,上下颠倒可混合,图中振荡操作不合理,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、反应原理、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合及实验的评价性分析,题目难度不大.

练习册系列答案
相关题目
7.下列状态的物质,既能导电又属于电解质的是( )
| A. | 熔融的KOH | B. | KOH溶液 | C. | 浓硫酸 | D. | KOH晶体 |
14.下列离子方程式,正确的是( )
| A. | 铜与盐酸反应:Cu+2H+═Cu2++H2↑ | |
| B. | 氧化铁与稀盐酸反应:Fe2O3+6H+═2Fe3++3H2O | |
| C. | 锌与硝酸银溶液反应:Zn+Ag+═Zn2++Ag | |
| D. | 在硫酸溶液中加入氢氧化钡溶液:Ba2++OH-+H++SO42-═BaSO4↓+H2O |
3.已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.0×10-16.下列关于不溶物之间转化的说法中错误的是( )
| A. | 向AgI中加一定浓度、一定体积的NaCl溶液,AgI可转化为AgCl | |
| B. | 常温下,AgCl若要在NaI溶液中开始转化为AgI,则NaI的浓度应该大于$\frac{1}{\sqrt{1.8}}$×10-11mol/L | |
| C. | AgI比AgCl更难溶于水,AgCl可以转化为AgI | |
| D. | 向c(Ag+)=1.8×10-4mol/L的溶液中加入等体积NaCl溶液,开始出现AgCl沉淀,则NaCl溶液浓度应大于1.0×10-6mol/L |
4.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钻矿(主要成分为CO2O3、Co(OH)3,还含少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
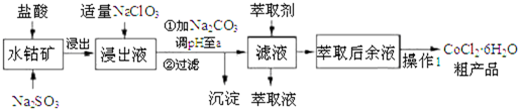
已知:①浸出液含有的阳离了主要有H+、CO2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mo1•L-l)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+:其使用的最佳pH范围是B
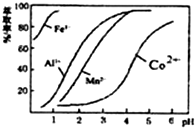
A 2.0~2.5 B 3.0~3.5 C 4.0~4.5 D 5.0~5.5
(5)“操作l”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoC12•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)

已知:①浸出液含有的阳离了主要有H+、CO2+、Fe2+、Mn2+、Al3+等:
②部分阳离子以氢氧化物形式沉淀时溶液的pH见表:(金属离子浓度为:0.01mo1•L-l)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+:其使用的最佳pH范围是B

A 2.0~2.5 B 3.0~3.5 C 4.0~4.5 D 5.0~5.5
(5)“操作l”中包含3个基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤.制得的CoC12•6H2O在烘干时需减压烘干的原因是降低烘干温度,防止产品分解.
(6)为测定粗产品中CoCl2•6H2O含量,称取一定质量的粗产品溶于水,加入足量AgNO3溶液,过滤、洗涤,将沉淀烘干后称其质量.通过计算发现粗产品中CoCl2•6H2O的质量分数大于100%,其原因可能是粗产品含有可溶性氯化物或晶体失去了部分结晶水.(答一条即可)