题目内容
19.对含氮物质的研究和利用有着极为重要的意义.(1)、N2、O2和H2相互之间可以发生化合反应,已知反应的热化学方程式如下:
N2(g)+O2(g)═2NO(g)△H=+180.5kJ•mol-1;
2H2(g)+O2(g)═2H2O(g)△H=-483.6kJ•mol-1;
N2(g)+3H2(g)═2NH3(g)△H=-92.4kJ•mol-1.
则氨的催化氧化反应的热化学方程式为4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ/mol.
(2)、氨气是化工生产的主要原料之一,在一固定容积为2L的密闭容器内加入0.2mol N2和0.5mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0
①当反应进行到第5分钟时达到平衡,测得NH3的浓度为0.1mol/L 则从反应开始到平衡时,v(N2)为0.01 mol/(L•min)
②下列描述中能说明上述反应已达平衡的是AF
A.容器内的总压强不再随时间而变化
B.混合气体的密度不再随时间变化
C.a molN≡N键断裂的同时,有6amolN-H键生成
D.N2、H2、NH3的分子数之比为1:3:2
E.3V正(H2)=2V逆(NH3)
F.容器中气体的平均分子量不随时间而变化
③若保持反应温度不变,再向容器中充入N2和NH3各0.1mol,则化学平衡将向左移动(填“向左”、“向右”或“不”)
④平衡后,下列措施既能提高该反应的速率又能增大N2的转化率的是CD
A.充入N2 B.升高温度 C.向原容器内继续充一定量NH3 D.增大压强
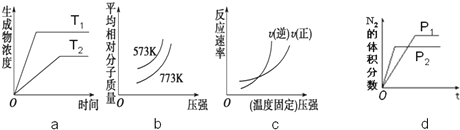
⑤若保持容器体积不变,下列图象正确的是bd
分析 (1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1;
③N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1.
根据盖斯定律,②×3+①×2-③×2可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g);
(2)①计算氨气的反应速率,速率之比等于化学方程式计量数之比计算得到氮气的反应速率;
②达到平衡状态时,正逆反应速率相等,各物质的浓度不变,百分含量不变,以及由此衍生其它一些物理量不变,据此结合选项判断;
③依据题干条件就是平衡常数,结合此时的浓度商和平衡常数比较平淡反应进行的方向;
④能加快该反应的反应速率,可以增大了压强、增大反应物浓度、升高温度;增大反应物转化率,说明平衡向着正向移动,据此进行分析;
⑤a.图象分析可知先拐先平温度高,T1>T2,升温平衡逆向进行;
b.定一议二,压强不变,温度越高平衡逆向进行,气体物质的量增大,温度一定的压强平衡正向进行气体物质的量减小;
c.压强增大反应速率增大,平衡正向进行;
d.图象分析可知先拐先平压强大,P1<P2,压强越大平衡正向进行;
解答 解:(1)已知:①N2(g)+O2(g)=2NO(g)△H=+180.5kJ•mol-1;
②2H2(g)+O2(g)=2H2O(g)△H=-483.6kJ•mol-1;
③N2(g)+3H2(g)=2NH3(g)△H=-92.4kJ•mol-1.
根据盖斯定律,②×3+①×2-③×2可得:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ/mol,
故答案为:4NH3(g)+5O2(g)=4NO(g)+6H2O(g)△H=-905kJ/mol;
(2)①当反应进行到第5分钟时达到平衡,测得NH3的浓度为0.1mol/L 则从反应开始到平衡时,v(NH3)=$\frac{0.1mol/L}{5min}$=0.02mol/L•min,v(N2)=$\frac{1}{2}$v(NH3)=0.01 mol/(L•min),
故答案为:0.01 mol/(L•min);
②A.反应前后气体物质的量发生变化,当压强不变说明反应达到平衡状态,故A正确;
B.反应混合气体的总质量不变,容器的容积不变,密度始终不变,容器中气体的密度不随时间而变化不能说明到达平衡状态,故B错误;
C.a molN≡N键断裂的同时,有6amolN-H键生成,只能说明反应正向进行,不能说明反应达到平衡状态,故C错误;
D.N2、H2、NH3的分子数之比为1:3:2,符合化学方程式计量数之比,但不能说明只能反应速率相同,不能说明到达平衡状态,故D错误;
E.不同物质表示的速率之比的与化学计量数之比,反应到达平衡状态,3v正(H2)=2v逆(NH3)即v正(H2):v逆(NH3)=2:3,不等于化学计量数之比,未到达平衡状态,逆反应速率较大,平衡向逆反应进行,故E错误;
F.反应混合气体的总质量不变,随反应进行,总的物质的量减小,故平均相对分子质量减小,容器中气体的平均相对分子量不随时间而变化,说明到达平衡状态,故F正确;
故答案为:AF;
③在一固定容积为2L的密闭容器内加入0.2mol N2和0.5mol H2,发生如下反应:N2(g)+3H2(g)?2NH3(g)△H<0,当反应进行到第5分钟时达到平衡,测得NH3的浓度为0.1mol/L,
N2(g)+3H2(g)?2NH3(g)△H<0,
起始量(mol/L) 0.1 0.25 0
变化量(mol/L) 0.05 0.15 0.1
平衡量(mol/L)0.05 0.1 0.1
K=$\frac{0.{1}^{2}}{0.05×0.{1}^{3}}$=200
若保持反应温度不变,再向容器中充入N2和NH3各0.1mol,此时物质浓度分别为:c(NH3)=0.15mol/L,c(N2)=0.1mol/L,c(H2)=0.1mol/L,则浓度商Q=$\frac{0.1{5}^{2}}{0.1×0.{1}^{3}}$=225>K=200,反应逆向进行,平衡向左移动,
故答案为:向左;
④A.充入N2平衡正向进行,反应速率增大,N2的转化率减小,故A错误;
B.升高温度反应速率增大,平衡逆向进行,氮气转化率减小,故B错误
C.向原容器内继续充一定量NH3 平衡逆向进行,氮气转化率减小,故C错误;
D.增大压强反应速率增大,平衡正向进行,氮气转化率增大,故D正确;
故答案为:CD;
⑤N2(g)+3H2(g)?2NH3(g)△H<0
a.图象分析可知先拐先平温度高,T1>T2,升温平衡逆向进行,生成物浓度减小,图象变化不符合,故a错误;
b.定一议二,压强不变,温度越高平衡逆向进行,气体物质的量增大,气体质量不变,则气体平均相对分子质量减小,温度一定的压强平衡正向进行气体物质的量减小,气体质量不变,则气体平均相对分子质量增大,图象变化符合,故b正确;
c.压强增大反应速率增大,平衡正向进行,正反应速率大于逆反应速率,图象变化不符合,故c错误;
d.图象分析可知先拐先平压强大,P1<P2,压强越大平衡正向进行,氮气体积分数减小,图象符合,故d正确;
故答案为:bd;
点评 本题考查化学反应速率的计算、化学平衡态的判断、化学平衡常数、影响化学平衡和反应速率的因素等,难度中等,注意化学平衡态的判断,选择判断的物理量应随反应进行发生变化,该物理量由变化到不变,说明到达平衡.

 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案 黄冈海淀全程培优测试卷系列答案
黄冈海淀全程培优测试卷系列答案| A. | 可将固体或浓溶液直接在容量瓶中溶解或稀释 | |
| B. | 氯化钠溶解于水,形成能够自由移动的水合钠离子和水合氯离子 | |
| C. | 失去电子越多的氧化剂,其氧化性就越强 | |
| D. | 物质的量浓度相等的盐酸和醋酸,导电能力相同 |
i.2CH3OH(g)?CH3OCH3(g)+H2O(g)
ii.2CH3OH(g)?C2H4(g)+H2O(g)
I.上述反应过程中能量变化如图所示:
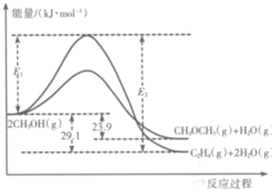
(1)在某密闭容器中,充人一定量CH3OH(g)发生上述两个反应,反应ⅰ(填“i”或“ii”)的速率较大,其原因为该反应的活化能较小.若在容器中加入催化剂,使ii的反应速率增大,则E1和E2-E1的变化是:
E1减小;E2-E1不变(填“增大”、“减小”或“不变”).
(2)已知:CH3CH2OH(g)=CH3OCH3(g)△H=+50.7kJ.mol-1.则乙烯气相直接水合反应C2H4(g)+H2O(g)=C2H5OH(g)的△H=-45.5 kJ•mol-1.
Ⅱ,某研究小组通过控制反应条件,在三个容积均为2L的密闭容器中只发生反应i,起始反应温度均为T℃,起始投料如下表所示:
起始投料/mol 编号 | CH3OH(g) | CH3OCH3(g) | H2O(g) |
| 恒温容器1 | 2 | 0 | 0 |
| 恒温容器2 | 0 | 2 | 2 |
| 绝热容器3 | 2 | 0 | 0 |
(4)若容器1中平衡时CH3OH(g)的转化率为80%,则该温度下反应i的平衡常数K=4.
| A. | 2C1>C2 | B. | 2C1=C2 | C. | 2C1<C2 | D. | 无法计算 |
| A. | 某物质焰色反应呈黄色,结论:该物质一定是钠盐 | |
| B. | 无色盐溶液中加入NaOH溶液,加热后产生的气体能使湿润的红色石蕊试纸变蓝,结论:原溶液中一定含有NH4+ | |
| C. | 无色溶液中加入BaCl2溶液,有白色沉淀产生,再加稀硝酸,沉淀不消失,结论:原溶液一定含有SO42- | |
| D. | 无色溶液中加入稀盐酸,产生无色无味气体,该气体能使澄清石灰水变浑浊,结论:原溶液一定含有CO32- |
 春节是传统的节日.在外地工作的人们会乘坐各种交通工具回家与亲人团圆.
春节是传统的节日.在外地工作的人们会乘坐各种交通工具回家与亲人团圆.