题目内容
1. 春节是传统的节日.在外地工作的人们会乘坐各种交通工具回家与亲人团圆.
春节是传统的节日.在外地工作的人们会乘坐各种交通工具回家与亲人团圆.①航空旅行舒适快捷.制造飞机轮胎的主要材料是b(填字母).
a.铝合金 b.橡胶 c.玻璃
②铁路是主要的交通工具.建设铁路需要大量水泥.工业上生产水泥的主要原料是石灰石和a (填字母).
a.黏土 b.纯碱 c.石英
③轮船也是重要的交通工具.为保护钢板不受腐蚀,在船尾(如图)钢板上镶嵌的金属块是b(填字母).
a.铜块 b.锌块 c.锡块.
分析 ①飞机轮胎应有弹性;
②生产水泥的主要原料是黏土、石灰石;
③原电池中活泼金属做负极.
解答 解:①飞机轮胎应有弹性,合金和玻璃无弹性,故答案为:b;
②生产水泥的主要原料是黏土、石灰石,故答案为:a;
③原电池中活泼金属做负极,腐蚀锌,保护了铁,故答案为:b.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.

练习册系列答案
相关题目
9.实验室制取气体时,不能用排空气法收集的是( )
| A. | NO | B. | NO2 | C. | NH3 | D. | SO2 |
16.用NA表示阿伏加德罗常数的值,下列说法正确的是( )
| A. | 28g氮气含有的原子数为NA | |
| B. | 标准状况下22.4L水中含有的水分子数为NA | |
| C. | 1molOH-含有的电子数为10NA | |
| D. | 0.1L 1mol/L NaCl溶液中含有Na+个数为NA |
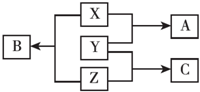 X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:
X、Y、Z三种短周期元素,其单质在常温下均为无色气体,它们的原子序数之和为16,在适当条件下三种单质两两直接化合,可发生如图所示变化.已知一个B分子中含有Z元素的原子个数比C分子中的Z元素的原子个数少一个.请回答下列问题:
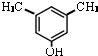 或
或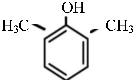 .
.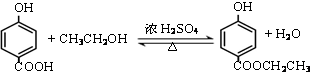 .
.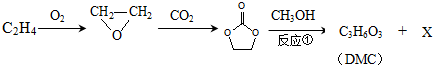
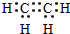 ;石油工业上获得C2H4的操作名称为:石油裂解
;石油工业上获得C2H4的操作名称为:石油裂解

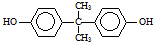 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式: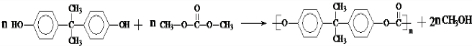 .
.