题目内容
4.下列能证明CH3COOH是弱电解质的实验个数是( )①常温下某CH3COONa溶液的pH=8
②用CH3COOH溶液做导电实验,灯泡很暗
③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多
④0.1mol/LCH3COOH溶液的pH=2.1
⑤CH3COONa和稀H3PO4反应生成CH3COOH
⑥pH=1的CH3COOH溶液稀释至100倍,pH<3.
| A. | 6 | B. | 5 | C. | 4 | D. | 3 |
分析 强弱电解质的根本区别是电离程度,部分电离的电解质是弱电解质,要证明醋酸是弱电解质,只要证明醋酸部分电离即可,可以根据醋酸钠溶液酸碱性、一定浓度的醋酸pH等方法判断,据此分析解答.
解答 解:①常温下某CH3COONa溶液的pH=8,说明醋酸钠是强碱弱酸盐,则醋酸为弱酸,故①正确;
②用CH3COOH溶液做导电实验,灯泡很暗,说明醋酸溶液中离子浓度较小,不能说明醋酸部分电离,所以不能证明醋酸是弱电解质,故②错误;
③等pH等体积的盐酸、CH3COOH溶液和足量锌反应,CH3COOH放出的氢气较多,说明醋酸中存在电离平衡,则醋酸部分电离为弱电解质,故③正确;
④0.1mol/L的CH3COOH溶液的pH=2.1,说明醋酸部分电离,为弱电解质,故④正确;
⑤CH3COONa和稀H3PO4反应生成CH3COOH,证明醋酸的酸性小于磷酸,而磷酸为弱电解质,则醋酸为弱电解质,故⑤正确;
⑥pH=1的CH3COOH溶液稀释100倍,pH<3,说明醋酸中存在电离平衡,为弱电解质,故⑥正确;
根据分析可知,能够证明醋酸为弱电解质的有5个,
故选B.
点评 本题考查强弱电解质判断,为高频考点,题目难度中等,明确强弱电解质根本区别是解本题关键,注意不能根据电解质溶液导电性强弱、电解质溶解性强弱等方法判断,为易错题.

练习册系列答案
相关题目
15.下列叙述中,正确的是( )
| A. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 金属阳离子被还原不一定得到金属单质 | |
| D. | 氧化还原反应中所有元素的化合价都发生变化 |
16.下列离子方程式不正确的是( )
| A. | 少量CO2通入漂白液中:CO2+ClO-+H2O═HClO+HCO3- | |
| B. | 向含K+、CO32-、OH-的溶液中通入少量CO2:2OH-+CO2═CO32-+H2O | |
| C. | 强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3═FeO42-+3Cl-+H2O+4H+ | |
| D. | 3molCl2通入含4molFeI2的溶液中充分反应:2I-+Cl2═I2+2Cl- |
14.胶体区别于其它分散系的本质特征是( )
| A. | 胶体能发生电泳现象 | B. | 胶体能产生丁达尔现象 | ||
| C. | 胶体粒子直径在1~100nm之间 | D. | 胶体在一定条件下能聚沉 |

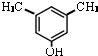 或
或 .
.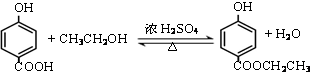 .
.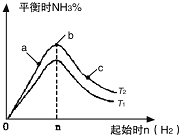 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.