题目内容
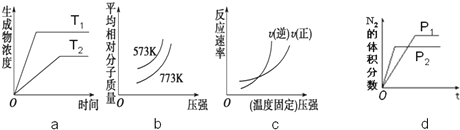
10.下列说法或判断正确的是( )| A. | 可将固体或浓溶液直接在容量瓶中溶解或稀释 | |
| B. | 氯化钠溶解于水,形成能够自由移动的水合钠离子和水合氯离子 | |
| C. | 失去电子越多的氧化剂,其氧化性就越强 | |
| D. | 物质的量浓度相等的盐酸和醋酸,导电能力相同 |
分析 A.容量瓶用于配制一定物质的量浓度溶液,不能溶解或稀释药品;
B.氯化钠溶于水后电离出钠离子和氯离子;
C.得电子的反应物作氧化剂,氧化剂的氧化性与得电子难易程度有关;
D.HCl是强电解质、醋酸是弱电解质,电解质溶液导电能力与离子浓度成正比.
解答 解:A.容量瓶用于配制一定物质的量浓度溶液,不能溶解或稀释药品,配制一定物质的量浓度溶液时,需要先将药品在烧杯中稀释或溶解,然后冷却至室温后再转移到容量瓶中配制溶液,故A错误;
B.氯化钠溶于水后电离出钠离子和氯离子,钠离子和氯离子和水生成水合钠离子和水合氯离子,故B正确;
C.得电子的反应物作氧化剂,氧化剂的氧化性与得电子难易程度有关,与得电子多少无关,故C错误;
D.HCl是强电解质、醋酸是弱电解质,电解质溶液导电能力与离子浓度成正比,物质的量浓度相同的醋酸和盐酸,盐酸中氢离子浓度大于醋酸,所以相同浓度的盐酸和醋酸,盐酸导电能力大于醋酸,故D错误;
故选B.
点评 本题考查较综合,涉及仪器的使用、电解质的电离、氧化性强弱比较、溶液导电能力影响因素等知识点,易错选项是CD,溶液导电能力与离子浓度成正比与电解质强弱无关,氧化剂的氧化性强弱与得电子难易程度有关,与得电子多少无关,题目难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
5.CO和H2的混合气体俗称合成气,是一种重要的工业原料气,工业上利用天然气(主要成分为CH4)与水进行高温重整制备合成气.
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ.写出甲烷与水蒸气的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
①计算该反应第一次达平衡时的平衡常数K0.135
②3min时改变的反应条件是升高温度或增大H2O的浓度或减小CO的浓度 (只填一种条件的改变即可).
(3)已知温度、压强、投料比X[$\frac{n(C{H}_{4})}{n({H}_{2}O}$]对该反应的影响如图所示.
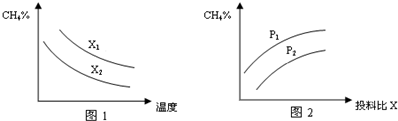
①图1中的两条曲线所示投料比的关系X1> X2(填“=”、“>”或“<”下同).
②图2中两条曲线所示的压强比的关系:P1> P2.
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
(1)已知:CH4、H2和CO的燃烧热(△H)分别为-890.3kJ/mol、-285.8kJ/mol和-283.0kJ/mol,且1mol液态水汽化时的能量变化为44.0kJ.写出甲烷与水蒸气的热化学方程式CH4(g)+H2O(g)=CO(g)+3H2(g)△H=+206.1kJ/mol
(2)在一定温度下,向体积为2L的密闭容器中充入0.40mol CH4和0.60mol H2O(g),测得CH4(g)和H2(g)的物质的量浓度随时间变化如下表所示:
| 时间/min 浓度 物质 | 0 | 1 | 2 | 3 | 4 |
| CH4 | 0.2mol•L-1 | 0.13mol•L-1 | 0.1mol•L-1 | 0.1mol•L-1 | 0.09mol•L-1 |
| H2 | 0mol•L-1 | 0.2mol•L-1 | 0.3mol•L-1 | 0.3mol•L-1 | 0.33mol•L-1 |
②3min时改变的反应条件是升高温度或增大H2O的浓度或减小CO的浓度 (只填一种条件的改变即可).
(3)已知温度、压强、投料比X[$\frac{n(C{H}_{4})}{n({H}_{2}O}$]对该反应的影响如图所示.

①图1中的两条曲线所示投料比的关系X1> X2(填“=”、“>”或“<”下同).
②图2中两条曲线所示的压强比的关系:P1> P2.
(4)以天然气(设杂质不参与反应)、KOH溶液为原料可设计成燃料电池:
①放电时,负极的电极反应式为CH4-8e-+10OH-=CO32-+7H2O
②设装置中盛有100.0mL 3.0mol/L KOH溶液,放电时参与反应的氧气在标准状况下的体积为8.96L,放电过程中没有气体逸出,则放电完毕后,所得溶液中各离子浓度由大到小的关系为c(K+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-).
15.下列叙述中,正确的是( )
| A. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 金属阳离子被还原不一定得到金属单质 | |
| D. | 氧化还原反应中所有元素的化合价都发生变化 |
20.已知三种酸HA、HB、HC的电离常数分别为a、b、c,且a>b>c,则对相同浓度的酸溶液叙述正确的是( )
| A. | HC的电离度最大 | |
| B. | HA溶液酸性最强 | |
| C. | HC溶液酸性最强 | |
| D. | 三种溶液中酸的电离程度:HA<HB<HC |
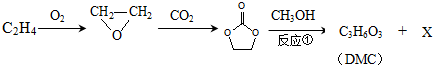
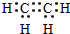 ;石油工业上获得C2H4的操作名称为:石油裂解
;石油工业上获得C2H4的操作名称为:石油裂解

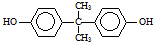 )在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式:
)在一定条件下可生成芳香族聚碳酸酯,写出反应的化学方程式: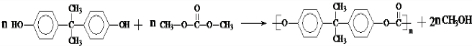 .
.