题目内容
7.如图是硫酸试剂瓶标签上的内容:
(1)该硫酸的物质的量浓度为18.4mol/L.
(2)某化学小组进行硫酸酸性实验探究时,需要240mL4.6mol/L的稀硫酸,则需要取上述的浓硫酸62.5mL.
(3)将上述浓硫酸进行稀释的实验操作是将量取的浓硫酸沿烧杯内壁缓缓地倒入盛有适量水的烧杯中,并用玻璃棒不断搅拌.
(4)在配制4.6mol/L稀硫酸的过程中,下列情况对所配制硫酸溶液物质的量浓度有何影响(填“偏高”“偏低”或“无影响”)?
①未经冷却趁热将溶液注入容量瓶中:偏高;
②定容时仰视读数:偏低;
③用量筒量取浓硫酸时俯视偏低;
④移液时不慎将少量溶液滴在容量瓶外面:偏低.
(5)实验过程中出现下列情况应如何处理?
①向容量瓶中加入蒸馏水至距刻度线1~2cm时,应该用胶头滴管滴加;
②加蒸馏水时不慎超过了刻度,应重新配制.
分析 (1)根据c=$\frac{1000ρω}{M}$计算该硫酸的物质的量浓度;
(2)需要由浓硫酸配制250ml240mL4.6mol/L的稀硫酸,根据稀释定律计算;
(3)浓硫酸稀释放热,应将密度大的浓硫酸缓慢注入水中,用玻璃棒不断搅拌散热;
(4)分析操作对溶质的物质的量和溶液体积的影响,依据c=$\frac{n}{V}$进行误差分析;
(5)①向容量瓶中加入蒸馏水至距刻度线1~2cm时,应该用胶头滴管滴加;
②加蒸馏水时不慎超过了刻度,导致c偏小,应重新配制.
解答 解:(1)由标签可知,该硫酸质量分数为98%,密度为1.84g/mL,故该硫酸的物质的量浓度c=$\frac{1000×1.84×98%}{98}$mol/L=18.4mol/L,
故答案为:18.4;
(2)需要由浓硫酸配制250ml240mL4.6mol/L的稀硫酸,设需要浓硫酸体积为V,根据稀释定律,V×18.4mol/L=4.6mol/L×250mL,解得V=62.5mL;
故答案为:62.5;
(3)浓硫酸稀释放热,应将量取的浓硫酸沿烧杯内壁缓缓地倒入盛有适量水的烧杯中,并用玻璃棒不断搅拌,
故答案为:将量取的浓硫酸沿烧杯内壁缓缓地倒入盛有适量水的烧杯中,并用玻璃棒不断搅拌;
(4)①未经冷却趁热将溶液注入容量瓶中,导致V偏小,因此c偏高,
故答案为:偏高;
②定容时仰视读数,导致V偏大,则c偏低,
故答案为:偏低;
③用量筒量取浓硫酸时俯视,导致n偏小,则c偏低,
故答案为:偏低;
④移液时不慎将少量溶液滴在容量瓶外面,导致n偏小,则c偏低,
故答案为:偏低;
(5)①向容量瓶中加入蒸馏水至距刻度线1~2cm时,应该用胶头滴管滴加,
故答案为:该用胶头滴管滴加;
②加蒸馏水时不慎超过了刻度,导致c偏小,应重新配制,
故答案为:重新配制.
点评 本题考查了一定物质的量浓度溶液的配制,明确配制原理和操作步骤是解题关键,注意浓硫酸的稀释及误差分析的方法,题目难度不大.

 阅读快车系列答案
阅读快车系列答案| A. | NO | B. | NO2 | C. | NH3 | D. | SO2 |
| A. | 在氧化还原反应中,非金属单质一定是氧化剂 | |
| B. | 某元素从化合态变为游离态时,该元素一定被还原 | |
| C. | 金属阳离子被还原不一定得到金属单质 | |
| D. | 氧化还原反应中所有元素的化合价都发生变化 |
| A. | 少量CO2通入漂白液中:CO2+ClO-+H2O═HClO+HCO3- | |
| B. | 向含K+、CO32-、OH-的溶液中通入少量CO2:2OH-+CO2═CO32-+H2O | |
| C. | 强碱溶液中NaClO与Fe(OH)3反应生成Na2FeO4:3ClO-+Fe(OH)3═FeO42-+3Cl-+H2O+4H+ | |
| D. | 3molCl2通入含4molFeI2的溶液中充分反应:2I-+Cl2═I2+2Cl- |
| A. | 被氧化的元素与被还原的元素质量比为1:1 | |
| B. | NaBH4是氧化剂,H2O是还原剂 | |
| C. | 硼元素被氧化,氢元素被还原 | |
| D. | NaBH4即使氧化剂又是还原剂 |
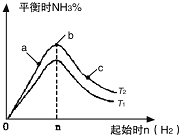 利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.
利用N2和H2可以实现NH3的工业合成,而氨又可以进一步制备硝酸.