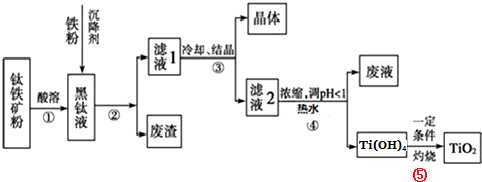
题目内容
 高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.
高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.I.如图是实验室制备氯气并进行一系列相关实验的装置(夹持设备已略).
(1)制备氯气选用的药品为:高锰酸钾和浓盐酸,相关的化学反应方程式为:
(2)装置B是安全瓶,监测实验进行时C中可能发生堵塞,请写出发生堵塞时B中的现象
(3)装置C的实验目的是验证氯气是否具有漂白性,为此C中I、II、III依次放入
| a | b | c | |
| I | 干燥的有色布条 | 湿润的有色布条 | 湿润的有色布条 |
| II | 碱石灰 | 浓硫酸 | 无水氯化钙 |
| III | 湿润的有色布条 | 干燥的有色布条 | 干燥的有色布条 |
II.硫酸钠-过氧化氢加合物(xNa2SO4?yH2O2?zH2O)的组成可通过下列实验测定:
①准确称取1.7700g样品,配制成100ml溶液A.
②准确量取25.00ml溶液A,加入盐酸酸化的BaCl2溶液至沉淀完全,过滤、洗涤、干燥至恒重,得到白色固体0.5825g.
③准确量取25.00ml溶液A,加入适量稀硫酸酸化后,用0.02000mol?L-1KMnO4溶液滴定至终点,消耗KMnO4溶液25.00ml.H2O2与KMnO4反应的离子方程式如下:2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
(1)上述滴定不加稀硫酸酸化,MnO4-被还原成MnO2,其离子方程式为:
(2)通过计算确定样品的化学式:
考点:氯气的实验室制法,探究物质的组成或测量物质的含量,氯、溴、碘的性质实验
专题:实验探究和数据处理题,实验设计题
分析:I.(1)高锰酸钾和浓盐酸在常温下反应生成氯气、氯化钾、氯化锰和水;
(2)依据C发生堵塞时,B中压强增大,分析解答;
(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(4)打开活塞,将装置D中少量溶液加入装置E中,生成的溴单质和碘化钾反应生成碘单质,碘单质溶解于苯中,振荡分层,苯层在上层;氯气和溴的氧化性均强于碘,D中过量的过量的Cl2也可将I-氧化为I2;
II.(1)不加稀硫酸酸化,MnO4-被还原为MnO2,双氧水被氧化生成氧气,根据电荷守恒可知有氢氧根离子生成,再根据原子守恒判断是否有水生成,配平书写;
(2)硫酸钠与氯化钡反应生成硫酸钡,依据硫原子个数守恒,由硫酸钡的质量计算硫酸钠的质量,求出硫酸钠的物质的量;
依据氧化还原反应滴定原理2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑求出双氧水的物质的量;
根据质量守恒,用总质量减去硫酸钠和双氧水的质量,求出水的质量,进而求出水的物质的量,依据n(Na2SO4):n(H2O2):n(H2O)=x:y:z计算想x、y、z的值,写出化学式.
(2)依据C发生堵塞时,B中压强增大,分析解答;
(3)验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性;
(4)打开活塞,将装置D中少量溶液加入装置E中,生成的溴单质和碘化钾反应生成碘单质,碘单质溶解于苯中,振荡分层,苯层在上层;氯气和溴的氧化性均强于碘,D中过量的过量的Cl2也可将I-氧化为I2;
II.(1)不加稀硫酸酸化,MnO4-被还原为MnO2,双氧水被氧化生成氧气,根据电荷守恒可知有氢氧根离子生成,再根据原子守恒判断是否有水生成,配平书写;
(2)硫酸钠与氯化钡反应生成硫酸钡,依据硫原子个数守恒,由硫酸钡的质量计算硫酸钠的质量,求出硫酸钠的物质的量;
依据氧化还原反应滴定原理2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑求出双氧水的物质的量;
根据质量守恒,用总质量减去硫酸钠和双氧水的质量,求出水的质量,进而求出水的物质的量,依据n(Na2SO4):n(H2O2):n(H2O)=x:y:z计算想x、y、z的值,写出化学式.
解答:
解:I.(1)高锰酸钾和浓盐酸在常温下反应制取氯气的化学方程式为:2KMnO4+16HCl(浓)=2MnCl2 +5Cl2↑+2KCl+8H2O;
故答案为:2KMnO4+16HCl(浓)=2MnCl2 +5Cl2↑+2KCl+8H2O;
(2)装置B是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,锥形瓶中液面下降,长颈漏斗中液面上升;
故答案为:锥形瓶中液面下降,长颈漏斗中液面上升;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选c,
故答案为:c;
(4)氯气与D中的溴化钠反应生成溴单质,打开活塞,将装置D中少量溶液加入装置E中,生成的溴单质和碘化钾反应生成碘单质,碘单质溶解于苯中显紫红色,振荡分层,苯层在上层,该现象不能说明溴的非金属性强于碘,氯气和溴的氧化性均强于碘,D中过量的过量的Cl2也可将I-氧化为I2;
故答案为:E中溶液分为两层,上层(苯层)为紫红色;过量的Cl2也可将I-氧化为I2;
II.(1)不加稀硫酸酸化,MnO4-被还原为MnO2,化合价由+7价将为+4价,得到3个电子,双氧水中两个-1价的氧均被氧化到氧气中的0价的氧,共失去2个电子,依据氧化剂得到的电子总数等于还原剂失去的电子总数,MnO4-的系数为2,则MnO2的系数为2,H2O2的系数为3,则O2系数为3,根据电荷守恒可知有OH-生成,其系数为2,由原子守恒可知,有水生成,其系数为2,反应离子方程式为:2MnO4-+3H2O2=2MnO2↓+3O2↑+2OH-+2H2O,
故答案为:2MnO4-+3H2O2=2MnO2↓+3O2↑+2OH-+2H2O;
(2)依据原子硫原子个数守恒:
Na2SO4~BaSO4
1 1
所以n(Na2SO4)=n(BaSO4)=
=2.50×10-3mol,
依据反应2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
2 5
0.02000mol?L-1×0.025L n(H2O2)
n(H2O2)=
×0.02000mol?L-1×0.025L/=1.25×10-3mol,
m(H2O2)=34g?mol-1×1.25×10-3mol=0.0425g,
依据质量守恒定律可知:n(H2O)=(1.7700g×
-0.355g-0.0425g)÷18g?mol-1=2.50×10-3mol,
所以:n(Na2SO4):n(H2O2):n(H2O)=x:y:z=2:1:2;
硫酸钠-过氧化氢加合物的化学式为2Na2SO4?H2O2?2H2O
答:硫酸钠-过氧化氢加合物的化学式为2Na2SO4?H2O2?2H2O.
故答案为:2KMnO4+16HCl(浓)=2MnCl2 +5Cl2↑+2KCl+8H2O;
(2)装置B是安全瓶,监测实验进行时C中是否发生堵塞,发生堵塞时B中的压强增大,锥形瓶中液面下降,长颈漏斗中液面上升;
故答案为:锥形瓶中液面下降,长颈漏斗中液面上升;
(3)装置C的实验目的是验证氯气是否具有漂白性,验证氯气是否具有漂白性,要验证干燥氯气无漂白性,湿润的有色布条中,氯气和水反应生成次氯酸具有漂白性,选项中abc的Ⅱ中都是干燥剂,再通入湿润的有色布条不能验证氯气的漂白性,所以C中I、II、III依次放入湿润的有色布条、无水氯化钙、干燥的有色布条,所以选c,
故答案为:c;
(4)氯气与D中的溴化钠反应生成溴单质,打开活塞,将装置D中少量溶液加入装置E中,生成的溴单质和碘化钾反应生成碘单质,碘单质溶解于苯中显紫红色,振荡分层,苯层在上层,该现象不能说明溴的非金属性强于碘,氯气和溴的氧化性均强于碘,D中过量的过量的Cl2也可将I-氧化为I2;
故答案为:E中溶液分为两层,上层(苯层)为紫红色;过量的Cl2也可将I-氧化为I2;
II.(1)不加稀硫酸酸化,MnO4-被还原为MnO2,化合价由+7价将为+4价,得到3个电子,双氧水中两个-1价的氧均被氧化到氧气中的0价的氧,共失去2个电子,依据氧化剂得到的电子总数等于还原剂失去的电子总数,MnO4-的系数为2,则MnO2的系数为2,H2O2的系数为3,则O2系数为3,根据电荷守恒可知有OH-生成,其系数为2,由原子守恒可知,有水生成,其系数为2,反应离子方程式为:2MnO4-+3H2O2=2MnO2↓+3O2↑+2OH-+2H2O,
故答案为:2MnO4-+3H2O2=2MnO2↓+3O2↑+2OH-+2H2O;
(2)依据原子硫原子个数守恒:
Na2SO4~BaSO4
1 1
所以n(Na2SO4)=n(BaSO4)=
| 0.5825g |
| 233g/mol |
依据反应2MnO4-+5H2O2+6H+=2Mn2++8H2O+5O2↑
2 5
0.02000mol?L-1×0.025L n(H2O2)
n(H2O2)=
| 5 |
| 2 |
m(H2O2)=34g?mol-1×1.25×10-3mol=0.0425g,
依据质量守恒定律可知:n(H2O)=(1.7700g×
| 25ml |
| 100ml |
所以:n(Na2SO4):n(H2O2):n(H2O)=x:y:z=2:1:2;
硫酸钠-过氧化氢加合物的化学式为2Na2SO4?H2O2?2H2O
答:硫酸钠-过氧化氢加合物的化学式为2Na2SO4?H2O2?2H2O.
点评:本题为综合题,考查了氯气的制备和性质的检验,氧化还原反应滴定,离子方程式书写及相关计算,难度中等,易错点为氧化还原方程式的配平,解题时注意得氧化还原反应中得失电子守恒、原子个数守恒等规律的应用.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
航天飞船高速进入大气层后,温度会迅速升高,其表层的复合材料可保护飞船不受破坏.这体现了该复合材料具有的特点是( )
| A、耐酸性 | B、耐热性 |
| C、耐腐蚀 | D、耐碱性 |
碳酸钠俗名纯碱,下面是对纯碱采用不同分类法的分类,不正确的是( )
| A、碱 | B、含氧酸盐 |
| C、钠盐 | D、碳酸盐 |
 ;
;
 和
和 也可以发生类似反应①的反应,有机产物的结构简式为
也可以发生类似反应①的反应,有机产物的结构简式为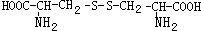
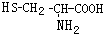 ,则下列说法错误的是
,则下列说法错误的是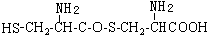
 可与NaOH溶液反应放出一种碱性气体.
可与NaOH溶液反应放出一种碱性气体.