题目内容
金属钛素有“太空金属”、“未来金属”等美誉.工业上,以钛铁矿为原料制备二氧化钛并得到副产品FeSO4?7H2O(绿矾)的工艺流程如下图所示.
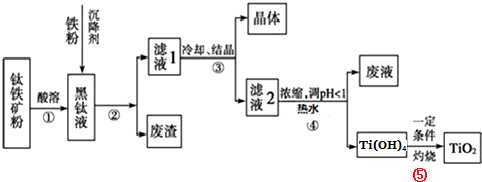
已知:TiO2+在一定条件下会发生水解;钛铁矿主要成分为钛酸亚铁(FeTiO3),含有少量SiO2杂质;其中一部分铁元素在钛铁矿处理过程中会转化为+3价.
(1)黑钛液中生成的主要阳离子有TiO2+和Fe2+,写出步骤①化学反应方程式: ;步骤②中,加入铁粉的主要目的是 .
(2)步骤③中,实现混合物的分离是利用物质的 (填字母序号).
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均涉及到的操作是 (填操作名称);在实验室完成步骤⑤“灼烧”所需主要仪器有 .
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为Ti(OH)4的原因: .
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为 .
(6)实验室通过下面方法可测定副产品绿矾中FeSO4?7H2O的质量分数.
a.称取2.85g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为19.00mL(滴定时发生反应的离子方程式为:Fe2++MnO4-+H+→Fe3++Mn2++H2O 未配平 ).
计算上述样品中FeSO4?7H2O的质量分数为 (用小数表示,保留二位小数).

已知:TiO2+在一定条件下会发生水解;钛铁矿主要成分为钛酸亚铁(FeTiO3),含有少量SiO2杂质;其中一部分铁元素在钛铁矿处理过程中会转化为+3价.
(1)黑钛液中生成的主要阳离子有TiO2+和Fe2+,写出步骤①化学反应方程式:
(2)步骤③中,实现混合物的分离是利用物质的
a.熔沸点差异 b.溶解性差异 c.氧化性、还原性差异
(3)步骤②、③、④中,均涉及到的操作是
(4)请结合化学用语用化学平衡理论解释步骤④中将TiO2+转化为Ti(OH)4的原因:
(5)可以利用生产过程中的废液与软锰矿(主要成分为MnO2)反应生产硫酸锰(MnSO4,易溶于水),该反应的离子方程式为
(6)实验室通过下面方法可测定副产品绿矾中FeSO4?7H2O的质量分数.
a.称取2.85g绿矾产品,溶解,在250mL容量瓶中定容;
b.量取25.00mL待测溶液于锥形瓶中;
c.用硫酸酸化的0.01mol/LKMnO4溶液滴定至终点,消耗KMnO4溶液体积的平均值为19.00mL(滴定时发生反应的离子方程式为:Fe2++MnO4-+H+→Fe3++Mn2++H2O 未配平 ).
计算上述样品中FeSO4?7H2O的质量分数为
考点:物质分离和提纯的方法和基本操作综合应用,探究物质的组成或测量物质的含量
专题:实验设计题
分析:流程分析:第①步加酸溶解生成TiO2+和Fe2+,第②步加铁粉还原Fe3+,过滤除去滤渣,第③步冷却结晶,过滤得到FeSO4?7H2O和含有TiO2+的溶液;第④步调节PH,使TiO2+水解生成Ti(OH)4,过滤得到Ti(OH)4;第⑤步Ti(OH)4受热分解生成化生成TiO2.
(1)FeTiO3与H2SO4反应生成FeSO4、TiOSO4和H2O;
(2)步骤③中,利用绿矾与TiOSO4的溶解性的差异实现混合物的分离;
(3)步骤②、③、④中均为分离固液混合物的操作;灼烧固体在坩埚中进行;
(4)升高温度促进水解平衡正移;
(5)生产过程中的废液含有Fe2+,与MnO2发生氧化还原反应;
(6)依据滴定实验的反应终点时发生的反应进行计算,依据铁元素守恒,结合滴定过程的反应离子方程式计算得到.
(1)FeTiO3与H2SO4反应生成FeSO4、TiOSO4和H2O;
(2)步骤③中,利用绿矾与TiOSO4的溶解性的差异实现混合物的分离;
(3)步骤②、③、④中均为分离固液混合物的操作;灼烧固体在坩埚中进行;
(4)升高温度促进水解平衡正移;
(5)生产过程中的废液含有Fe2+,与MnO2发生氧化还原反应;
(6)依据滴定实验的反应终点时发生的反应进行计算,依据铁元素守恒,结合滴定过程的反应离子方程式计算得到.
解答:
解:流程分析:第①步加酸溶解生成TiO2+和Fe2+,第②步加铁粉还原Fe3+,过滤除去滤渣,第③步冷却结晶,过滤得到FeSO4?7H2O和含有TiO2+的溶液;第④步调节PH,使TiO2+水解生成Ti(OH)4,过滤得到Ti(OH)4;第⑤步Ti(OH)4受热分解生成化生成TiO2.
(1)FeTiO3与H2SO4反应生成FeSO4、TiOSO4和H2O,则其化学反应方程式为:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;亚铁离子易被氧化,则加入铁粉的主要目的是将Fe3+转化为Fe2+并防止Fe2+被氧化;
故答案为:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;将Fe3+转化为Fe2+并防止Fe2+被氧化;
(2)步骤③中,利用绿矾与TiOSO4的溶解性的差异实现混合物的分离,把混合物的溶液冷却结晶得到绿矾固体,故答案为:b;
(3)步骤②、③、④中均为分离固液混合物的操作,则操作为过滤;灼烧固体一般在坩埚中进行,故答案为:过滤;坩埚;
(4)TiO2+在一定条件下会发生水解生成Ti(OH)4和氢离子,溶液中存在平衡:TiO2++3H2O Ti(OH)4+2H+,升高温度促进水解平衡正移,生成Ti(OH)4;
Ti(OH)4+2H+,升高温度促进水解平衡正移,生成Ti(OH)4;
故答案为:溶液中存在平衡:TiO2++3H2O Ti(OH)4+2H+,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4;
Ti(OH)4+2H+,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4;
(5)生产过程中的废液含有Fe2+,与MnO2发生氧化还原反应生成硫酸锰,其反应的离子方程式为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O;
(6)5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01mol/L×0.019L
计算得到:n(Fe2+)=0.00095mol;
则250mL溶液中含Fe2+为0.00095mol×
=0.0095mol;
FeSO4?7H2O物质的量为0.0095mol,其质量为0.0095mol×278g/mol=2.641g
绿矾的质量分数=
=0.93,
故答案为:0.93.
(1)FeTiO3与H2SO4反应生成FeSO4、TiOSO4和H2O,则其化学反应方程式为:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;亚铁离子易被氧化,则加入铁粉的主要目的是将Fe3+转化为Fe2+并防止Fe2+被氧化;
故答案为:FeTiO3+2H2SO4═FeSO4+TiOSO4+2H2O;将Fe3+转化为Fe2+并防止Fe2+被氧化;
(2)步骤③中,利用绿矾与TiOSO4的溶解性的差异实现混合物的分离,把混合物的溶液冷却结晶得到绿矾固体,故答案为:b;
(3)步骤②、③、④中均为分离固液混合物的操作,则操作为过滤;灼烧固体一般在坩埚中进行,故答案为:过滤;坩埚;
(4)TiO2+在一定条件下会发生水解生成Ti(OH)4和氢离子,溶液中存在平衡:TiO2++3H2O
 Ti(OH)4+2H+,升高温度促进水解平衡正移,生成Ti(OH)4;
Ti(OH)4+2H+,升高温度促进水解平衡正移,生成Ti(OH)4;故答案为:溶液中存在平衡:TiO2++3H2O
 Ti(OH)4+2H+,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4;
Ti(OH)4+2H+,当加入热水稀释、升温后,平衡正向移动,生成Ti(OH)4;(5)生产过程中的废液含有Fe2+,与MnO2发生氧化还原反应生成硫酸锰,其反应的离子方程式为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O,
故答案为:MnO2+2Fe2++4H+═Mn2++2Fe3++2H2O;
(6)5Fe2++MnO4-+8H+═5Fe3++Mn2++4H2O
5 1
n(Fe2+) 0.01mol/L×0.019L
计算得到:n(Fe2+)=0.00095mol;
则250mL溶液中含Fe2+为0.00095mol×
| 250 |
| 25 |
FeSO4?7H2O物质的量为0.0095mol,其质量为0.0095mol×278g/mol=2.641g
绿矾的质量分数=
| 2.641g |
| 2.85g |
故答案为:0.93.
点评:本题考查了物质制备流程分析判断,实验基本操作,离子方程式的书写,数据计算等,题目涉及的知识点较多,综合性强,考查学生对所学知识的综合应用能力,题目难度中等.

练习册系列答案
 中考解读考点精练系列答案
中考解读考点精练系列答案 各地期末复习特训卷系列答案
各地期末复习特训卷系列答案
相关题目
化肥的合理利用显示了化学在促进农业现代化进程中的重要作用.下列化肥既属于氮肥又属于钾肥的是( )
| A、草木灰 | B、尿素 |
| C、硝酸钾 | D、氨水 |
某溶液中n(K+)=n(Na+)=n(Cl-)=2n(SO42-),则该溶液可能是( )
| A、KCl与Na2SO4的混合液 |
| B、NaCl与K2SO4、MgSO4的混合液 |
| C、NaCl、KCl、Na2SO4的混合液 |
| D、Na2SO4、K2SO4、KCl的混合液 |
 高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.
高锰酸钾是一种典型的强氧化剂,无论在实验室还是在化工生产中都有重要的应用.