题目内容
1.实验室有一包固体粉末样品可能是MgCO3、Fe2O3和FeO的混合物.I.甲学生设计实验方案,以确定样品中是否含有FeO,除样品外,
实验室只提供以下试剂:KMnO4溶液、盐酸、稀硫酸、KSCN溶液、NaOH溶液,
请你描述甲学生的实验操作步骤、现象及结论:取少量样品于试管中,加入稀硫酸溶解,再加入少量KMnO4溶液,溶液不褪色,说明样品中没有FeO.
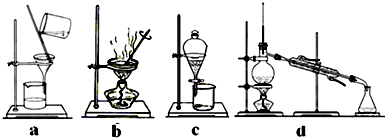
Ⅱ.经甲学生实验确定该样品中不存在FeO,乙学生想在甲学生的实验基础上进一步来测定混合物中Fe2O3的含量:乙学生准备用如图所示各仪器按一定顺序连接成一套完整的装置进行实验,以测定Fe2O3的质量分数.
请回答下列问题:
(1)盛装盐酸的仪器的名称是分液漏斗,装置的连接顺序是:B→D→A→C(填图中字母序号,各仪器只能选用一次).
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物以实现充分反应外,还有一个重要作用是:将D中生成的CO2全部赶入A装置中.
(3)为提高测定的准确度,在B中最应加入的物质是:d(填字母编号).
a.饱和NaHCO3溶液 b.蒸馏水 c.浓硫酸 d.NaOH溶液
(4)在进行乙学生的实验方案评价时,有学生认为不必测定A中沉淀的质量,而只要测出装置A在吸收反应产生的气体前后的质量差,就能完成实验要求.实验证明,若用此法测得Fe2O3的质量分数将偏小(填“偏大”、“偏小”或“不变”).
分析 I.Fe不易溶于水中,应该用酸溶解样品,亚铁离子具有还原性,用强氧化性物质检验亚铁离子且必须有明显现象;
Ⅱ.(1)盛放盐酸的仪器为分液漏斗;先分析实验方案,利用装置B除去空气中的二氧化碳,然后用空气将装置D产生的二氧化碳完全赶到装置A中,为了避免空气中水和二氧化碳干扰,装置A需要连接吸收二氧化碳和水的装置,据此对装置进行排序;
(2)根据通入空气还可以将碳酸钙与盐酸反应生成的二氧化碳驱赶到装置B中分析;
(3)空气中含有二氧化碳,会影响实验测定,需要用氢氧化钠溶液吸收;
(4)由于反应生成的二氧化碳中含有杂质氯化氢和水,导致测定的装置A的质量差增大,测定碳酸钙质量偏大,氧化铁的质量分数偏低
解答 解:I.要检验FeO,应该先将FeO转化为亚铁离子,亚铁离子具有还原性,酸性高锰酸钾溶液能氧化亚铁离子而褪色,高锰酸钾溶液具有强氧化性,能氧化盐酸,所以不能用盐酸酸化高锰酸钾,其检验方法为:取少量样品于试管中,加入稀硫酸溶解,再加入少量KMnO4溶液,溶液不褪色,说明样品中没有FeO,
故答案为:取少量样品于试管中,加入稀硫酸溶解,再加入少量KMnO4溶液,溶液不褪色,说明样品中没有FeO;
Ⅱ.(1)根据图示可知,盛放盐酸的装置为分液漏斗;测定样品中Fe2O3的质量分数,先根据CaCO3产生的CO2的质量计算出m(CaCO3),再根据样品质量计算出Fe2O3的质量分数,仪器连接顺序为:先将空气通入盛有NaOH溶液的装置B,以便除去空气中的CO2碳,然后利用空气将装置D中产生的CO2驱赶到装置A,利用CO2与Ba(OH)2生成的BaCO3沉淀的质量计算出m(CaCO3),由于空气中的CO2、水蒸气影响测定结果,需要在装置A后连接一个吸收CO2、水蒸气的装置C,所以装置连接顺序为:BDAC,
故答案为:分液漏斗;B;D;A;C;
(2)实验过程中需要持续通入空气,其作用除可以起到“搅拌”A、D中反应物达到充分反应外,还可以使反应生成的CO2尽可能彻底的赶入装置A中,使反应生成的CO2能够被Ba(OH)2溶液完全吸收,
故答案为:将反应产生的CO2气体尽可能彻底的赶入装置A中,使之完全被Ba(OH)2溶液吸收;
(3)空气中含有CO2,会影响实验测定,而装置B中应该盛放NaOH溶液,从而吸收空气中的CO2,避免空气中的CO2影响测定结果,故d正确,
故答案为:d;
(4)由于装置D生成的CO2中混有HCl和水,导致装置A在吸收反应产生的气体前后的质量差偏大,测定的CO2的质量偏大,m(CaCO3)会偏大,样品中m(Fe2O3)偏小,Fe2O3的质量分数会偏小,
故答案为:偏小.
点评 本题考查物质检验和鉴别的实验方案设计,为高频考点,涉及离子检验、实验装置排序、实验设计等,明确物质性质是解本题关键,注意:高锰酸钾溶液能氧化浓盐酸,所以酸性高锰酸钾溶液中不能滴加浓盐酸,为易错点.

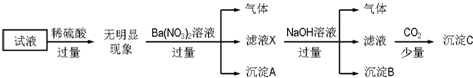
下列说法正确的是( )
| A. | 原溶液中存在的离子为NH4+、Fe2+、Cl-、SO42- | |
| B. | 无法确定原试液中是否含有K+ | |
| C. | 滤液X中大量存在的阳离子有NH4+、Fe2+和Ba2+ | |
| D. | 无法确定沉淀C的成分 |
| A. | 0.43 | B. | 0.47 | C. | 0.49 | D. | 0.52 |
| A. | 白铁(镀Zn铁)表面有划损时,也能阻止铁被氧化 | |
| B. | 在空气中金属铝表面迅速被氧化形成保护膜 | |
| C. | 红热的铁丝与水接触表面形成蓝色保护层 | |
| D. | 在铁与稀H2SO4反应时,改用铁粉,可加快H2的产生 |
| ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | VⅡA | 0 | |
| 2 | ⑥ | ⑦ | ⑪ | |||||
| 3 | ① | ③ | ⑤ | ⑧ | ⑩ |
(2)①③⑤三种元素的最高价氧化物水化物中,碱性最强的NaOH.①③⑤三种元素的原子半径由大到小的顺序为Na>Mg>Al.
(3)①元素的某氧化物通常用作供氧剂,请写出它与⑦元素的氧化物反应的化学方程式2Na2O2+2H2O=4NaOH+O2↑.
 二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如图所示.常温下,S2Cl2 遇水易水解,并产生能使品红褪色的气体.下列说法错误的是( )| A. | S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O=SO2↑+3S↓+4HCl | |
| B. | S2Cl2为含有极性键和非极性键的极性分子 | |
| C. | S2Br2与S2Cl2结构相似,熔沸点:S2Br2>S2Cl2 | |
| D. | S2Cl2的电子式是:Cl |
I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,不断通入氯气至完全反应;
IV.加热蒸发、浓缩结晶,得到FeCl3•6H2O晶体.
(1)用FeCl3溶液腐蚀铜箔的离子方程式是Cu+2Fe3+=Cu2++2Fe2+,.
(2)试剂A是盐酸.
(3)步骤III反应过程中既有Fe2+又有Fe3+,如果要验证滤液中铁元素的存在形式,可另取反应过程中的两份滤液分别进行实验,实验方法、现象与结论如下表,请将其补充完整.可供选择的试剂:
a.酸性KMnO4 b.NaOH溶液 c.KSCN溶液 d.氯水
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液中加入c(填字母) | 液变成血红色 | 滤液中有Fe3+ |
| 步骤2:在滤液中加入a(填字母) | 紫红色褪去 | 滤液中有Fe2+ |