题目内容
11.电子工业中用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液.由该废液回收铜并得到净水剂(FeCl3•6H2O)的步骤如下:I.在废液中加入过量铁粉,过滤;
II.向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜;
III.合并I和II中的滤液,不断通入氯气至完全反应;
IV.加热蒸发、浓缩结晶,得到FeCl3•6H2O晶体.
(1)用FeCl3溶液腐蚀铜箔的离子方程式是Cu+2Fe3+=Cu2++2Fe2+,.
(2)试剂A是盐酸.
(3)步骤III反应过程中既有Fe2+又有Fe3+,如果要验证滤液中铁元素的存在形式,可另取反应过程中的两份滤液分别进行实验,实验方法、现象与结论如下表,请将其补充完整.可供选择的试剂:
a.酸性KMnO4 b.NaOH溶液 c.KSCN溶液 d.氯水
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液中加入c(填字母) | 液变成血红色 | 滤液中有Fe3+ |
| 步骤2:在滤液中加入a(填字母) | 紫红色褪去 | 滤液中有Fe2+ |
分析 用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液,则废液中含FeCl3、FeCl2、CuCl2.
Ⅰ.在废液中加入过量铁粉,则会与FeCl3反应生成FeCl2,与CuCl2反应生成FeCl2和Cu,过滤,则滤液中含FeCl2;滤渣中含Cu和过量的Fe粉;
Ⅱ.I的滤渣中含Cu和过量的Fe粉,向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜,故加入的试剂A只能将铁反应掉,则A为盐酸,所得的溶液中含FeCl2;
Ⅲ.I和II中的滤液中均为FeCl2,通入足量氯气,反应生成FeCl3;
Ⅳ.加热蒸发、浓缩结晶,得到FeCl3•6H2O晶体.据此分析.
解答 解:用过量的FeCl3溶液溶解电路板中的铜箔时,会产生大量废液,则废液中含FeCl3、FeCl2、CuCl2.
Ⅰ.在废液中加入过量铁粉,则会与FeCl3反应生成FeCl2,与CuCl2反应生成FeCl2和Cu,过滤,则滤液中含FeCl2;滤渣中含Cu和过量的Fe粉;
Ⅱ.I的滤渣中含Cu和过量的Fe粉,向I的滤渣中加入过量试剂A,充分反应后,过滤,得到铜,故加入的试剂A只能将铁反应掉,则A为盐酸,所得的溶液中含FeCl2;
Ⅲ.I和II中的滤液中均为FeCl2,通入足量氯气,反应生成FeCl3;
Ⅳ.加热蒸发、浓缩结晶,得到FeCl3•6H2O晶体.
(1)铜与氯化铁反应生成氯化铁、氯化亚铁,化学方程式为:2FeCl3+Cu═2 FeCl2+CuCl2,所以离子方程式是Cu+2Fe3+=Cu2++2Fe2+,故答案为:Cu+2Fe3+=Cu2++2Fe2+;
(2)试剂A只能将铁反应掉,不反应铜,且不能引入杂质离子,故A为盐酸,故答案为:盐酸;
(3)在滤液中加入KSCN溶液,溶液变血红色,说明滤液中有Fe3+,在滤液中加入酸性KMnO4,如果紫红色褪去,说明溶液中存在亚铁离子,故答案为:
| 实验方法 | 实验现象 | 结论 |
| 步骤1:在滤液中加入 c(填字母) | 液变成血红色 | 滤液中有Fe3+ |
| 步骤2:在滤液中加入 a(填字母) | 紫红色褪去 | 滤液中有Fe2+ |
点评 本题考查了氯化铁来腐蚀电路铜板的反应和所需试剂的推导,难度不大,应注意的是由溶液获得带结晶水的晶体的方法.

| A. | 无色溶液:Na+、K+、SO42-、MnO4- | |
| B. | pH=1的溶液中:Fe2+、SO42-、Cl-、NO3- | |
| C. | 使酚酞变红的溶液:Na+、Cl-、SO42-、Fe3+、 | |
| D. | 水电离出的c(H+)=1×10-12mol/L的溶液:K+、Cl-、Ba2+、Br- |
| 阳离子 | Na+、K+、Cu2+ |
| 阴离子 | SO${\;}_{4}^{2-}$、OH- |
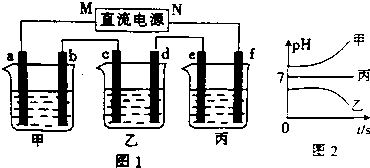
(1)电极b上发生的电极反应为4OH--4e-=2H2O+O2↑.
(2)写出乙烧杯的电解池总反应化学方程式2CuSO4+2H2O$\frac{\underline{\;通电\;}}{\;}$2Cu+O2↑+2H2SO4.
(3)用惰性电极电解B溶液,当阳离子浓度下降至一半时停止通电,加入下列物质不能使该溶液恢复至起始状态的是C.
A、CuO B、CuO C、Cu(OH)2 D、CuCO3
(4)如果电解过程中B溶液中的金属离子全部析出,此时电解能否继续进行能(填“能”或“不能”).
(5)计算电极e上生成的气体在标准状态下的体积5.6L.
(6)要使丙烧杯溶液恢复到原来的状态,操作是向丙烧杯中加入4.5g水.
| IA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 | |
| 1 | ① | |||||||
| 2 | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ||
| 3 | ⑧ | ⑨ | ⑩ |
(2)⑧⑨⑩的离子半径由大到小的顺序为S2->Cl->Na+(填化学用语).
(3)写出由⑥、⑧、⑩元素形成的一种离子化合物的电子式

(4)根据斜线性质相似规则,②的最高价氧化物对应的水化物与盐酸反应的离子方程式LiOH+H+=Li++H2O
(5)③的氧化物,氢氧化物有两性,写出③的单质与⑧的最高价氧化物的水化物反应的化学方程式Be+2OH-=BeO22-+H2↑
(6)已知W+X=Y+Z,W、X、Y、Z分别是由①⑤⑥三种元素形成的四种十电子粒子,写出该反应式NH4++OH-=NH3+H2O.
| A. | 甲基橙呈黄色的溶液中:K+、Na+、SO42-、S2O32- | |
| B. | 能与Al反应生成H2的溶液:Na+、Ba2+、NO3-、I- | |
| C. | 常温下水电离出的OH-为1×10-7mol/L的溶液中:K+、Na+、SO42-、AlO2- | |
| D. | 常温下pH=7的溶液中:NH4+、K+、CH3COO-、NO3- |
| A. | Cl-、NO3-、Fe3+、Na+ | B. | Ag+、NO3-、Cl-、K+ | ||
| C. | K+、Ba2+、OH-、SO42- | D. | Cu2+、NH4+、Br-、OH- |
| A. | 向以上平衡体系中加入足量浓NaOH溶液,两平衡都向右移动,Al(OH)3的质量增加 | |
| B. | 向以上平衡体系中加入足量浓盐酸,Al3+的物质的量增加 | |
| C. | 在同一溶液中,Al3+与OH-能大量共存 | |
| D. | 在同一溶液中,AlO2-与H+能大量共存 |
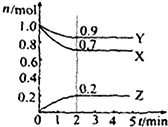 某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析:
某温度时在2L容器中X、Y、Z三种物质的物质的量(n)随时间(t)变化的曲线如图所示,图中数据分析: