题目内容
将等物质的量的A、B、C、D四种物质混合,发生如下反应:aA+bB?cC(s)+dD,当反应进行一定时间后,测得A减少了n mol,B减少了
mol,C增加了
mol,D增加了nmol,此时到达化学平衡.
(1)该化学方程式各物质的系数之比为 .
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态为:A ,B ,D .
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到了相等,则该反应为 反应(填“放热”或“吸热”).
| n |
| 2 |
| 3n |
| 2 |
(1)该化学方程式各物质的系数之比为
(2)若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态为:A
(3)若只升高温度,反应一段时间后,测知四种物质其物质的量又达到了相等,则该反应为
考点:化学平衡的影响因素,化学反应速率和化学计量数的关系
专题:
分析:(1)根据同一化学反应的同一时间段内,参加反应的各物质的物质的量与计量数的关系判断;
(2)根据压强对化学平衡的影响判断;
(3)根据温度对化学平衡的影响判断.
(2)根据压强对化学平衡的影响判断;
(3)根据温度对化学平衡的影响判断.
解答:
解:(1)同一化学反应的同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,所以a:b:c:d=n mol:n/2mol:3n/2mol:n mol=2:1:3:2,故答案为:2:1:3:2;
(2)压强对化学反应前后气体体积不变的可逆反应的平衡状态无影响,根据题意知,该反应前后气体体积不变;
2A+B?3 C+2D中,已知生成物C是固体,要使反应前后气体体积不变即计量数不变,那么只能是A、D是气体,B是液体或固体,
故答案为:气体;固体或液体;气体;
(3)升高温度,平衡向吸热方向移动;根据题意知,开始反应时,A、B的物质的量减少,C、D的物质的量增加,所以平衡向正反应方向移动;升高温度,反应一段时间后,测知这四种物质的物质的量相等,说明平衡向逆反应方向移动,所以正反应是放热反应.
故答案为:放热.
(2)压强对化学反应前后气体体积不变的可逆反应的平衡状态无影响,根据题意知,该反应前后气体体积不变;
2A+B?3 C+2D中,已知生成物C是固体,要使反应前后气体体积不变即计量数不变,那么只能是A、D是气体,B是液体或固体,
故答案为:气体;固体或液体;气体;
(3)升高温度,平衡向吸热方向移动;根据题意知,开始反应时,A、B的物质的量减少,C、D的物质的量增加,所以平衡向正反应方向移动;升高温度,反应一段时间后,测知这四种物质的物质的量相等,说明平衡向逆反应方向移动,所以正反应是放热反应.
故答案为:放热.
点评:外界条件对化学平衡的影响适用范围:浓度对化学平衡的影响适用于气体或液体;压强对化学平衡的影响适用于有气体参加且反应前后气体体积变化的反应;温度对所有可逆反应都有影响,无论该反应放热还是吸热;

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列离子方程式书写正确的是( )
| A、铁跟稀硫酸反应:2Fe+6H+═2Fe3++3H2↑ |
| B、盐酸与澄清石灰水反应:H++OH-═H2O |
| C、碳酸钙与醋酸反应:CaCO3+2H+═Ca2++CO2↑+H2O |
| D、二氧化碳通入足量的氢氧化钠溶液:CO2+OH-═HCO3- |
下列电池工作时,O2在正极放电的是( )
 |  |  |  |
| A.锌锰电池 | B.氨燃料电池 | C.铅蓄电池 | D.镍镉电池 |
| A、A | B、B | C、C | D、D |
 容积均为500 mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1 mol N2和2.5 mol H2,三个容器的反应温度分别为T1,T2,T3且恒定不变,在其他条件相同的情况下发生反应:N2+3H2?2NH3(△H<0).实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )
容积均为500 mL的Ⅰ,Ⅱ,Ⅲ三个密闭容器(容器体积恒定不变)中分别充入1 mol N2和2.5 mol H2,三个容器的反应温度分别为T1,T2,T3且恒定不变,在其他条件相同的情况下发生反应:N2+3H2?2NH3(△H<0).实验测得反应均进行到t min时N2的体积分数如图所示.下列说法正确的是( )| A、当v(H2)=3v(N2)时,可以说明三个容器中的反应达平衡状态 |
| B、在t min时,一定达化学平衡状态的是Ⅱ和Ⅲ |
| C、在t min时测得c(N2)Ⅲ=1 mol/L,若再向Ⅲ中充入1.5 mol N2和1 mol NH3,H2的转化率不变 |
| D、三个容器中的反应均达到平衡后,容器I中混合气体的平均相对分子质量最小 |
日常生活中,下列做法中不会对人体健康造成危害的是( )
| A、腌制腊类物质添加大量亚硝酸钠 |
| B、金针菇可用福尔马林浸泡来达到保鲜的目的 |
| C、用NaHCO3发酵面包 |
| D、竹笋用二氧化硫气体漂白 |
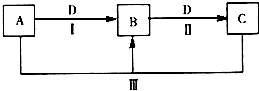 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图所示(部分产物已略去).
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化关系如图所示(部分产物已略去).