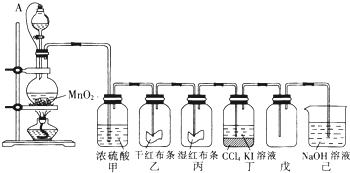
题目内容
等物质量浓度的FeBr3和CuCl2的混合溶液用惰性电极电解最初在负极发生反应的离子是( )
| A、Fe3+ |
| B、Br- |
| C、Cu2+ |
| D、Cl- |
考点:电解原理
专题:电化学专题
分析:根据电解池的工作原理,和电解池的负极相连的是阴极,在阴极上是阳离子发生得电子的还原反应.
解答:
解:等物质量浓度的FeBr3和CuCl2的混合溶液中含有铁离子、铜离子、溴离子和氯离子,在阴极上是阳离子得电子,根据得电子能力:铁离子>铜离子,所以最初在负极发生反应的离子是铁离子.
故选A.
故选A.
点评:本题考查学生电解池的工作原理知识,注意两极上离子的放电顺序是解题的关键,难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
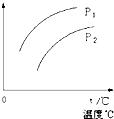 在容积一定的密闭容器中发生可逆反应Y(g)+2X(g)?2Z(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应Y(g)+2X(g)?2Z(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )| A、P1>P2,纵坐标指Y的质量分数 |
| B、P1<P2,纵坐标指X的转化率 |
| C、P1>P2,纵坐标指Z的质量分数 |
| D、P1<P2,纵坐标指混合气体的平均摩尔质量 |
生铁的熔点是1100℃~1200℃,则纯铁的熔点可能是( )
| A、1055℃ |
| B、1100℃ |
| C、1200℃ |
| D、1535℃ |
已知反应3Cl2+6NaOH=5NaCl+NaClO3+3H2O下列说法正确的是( )
| A、Cl2既是氧化剂也是还原剂 |
| B、该反应中的电子转移数目为6e- |
| C、氧化剂和还原剂的质量比是1:5 |
| D、NaCl是氧化产物,NaClO3是还原产物 |
下列叙述正确的是( )
A、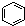 和 和 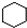 均是芳香烃, 均是芳香烃,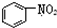 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
| B、分子式为C3H6Cl2的有机物共有5种同分异构体(不考虑立体异构) |
| C、分子式为C4H8有机物最多存在4个C-C单键 |
| D、分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可推测有机物结构简式为C2H5-OH |
某温度时,Kw=1×10-12,下列说法正确的是( )
| A、pH=2的盐酸和pH=12的NaOH溶液等体积混合后,溶液的pH=7 | ||
| B、pH=11的氨水中c(OH-)=0.1mol?L-1 | ||
C、向盐酸中滴加氨水至溶液的pH=6,所得溶液中c(Cl-)>c(N
| ||
| D、将pH=4.5的盐酸稀释100倍后,溶液的pH=6.5 |
某无色溶液能与铝反应产生氢气,则在该溶液中不可能大量存在的离子组为( )
| A、Na+、Fe3+、NO3-、Cl |
| B、K+、Na+、Cl-、SO42- |
| C、K+、Ba2+、Br-、Cl- |
| D、NH4+、Na+、CO32-、PO43- |
下列分子式表示的物质一定是纯净物的是( )
| A、C5H10 |
| B、C7H8O |
| C、CH4O |
| D、C2H4O2 |