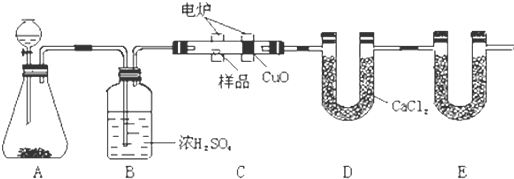
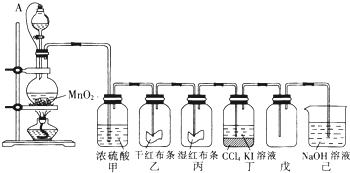
题目内容
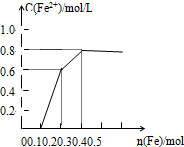 向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.
向含Fe(NO3)3、Cu(NO3)2、HNO3的稀溶液中逐渐加入铁粉,c(Fe2+)的变化如图所示.(1)横坐标n(Fe)为0~0.1段反应的离子方程式为:
(2)忽略溶液体积的变化,则原溶液Cu(NO3)2的浓度为
考点:有关混合物反应的计算
专题:
分析:根据氧化性:HNO3>Fe3+>Cu2+,Fe先与氧化性强的物质反应,开始发生反应:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,然后是发生Fe+2Fe3+=3Fe2+,最后阶段发生Fe+Cu2+═Fe2++Cu,根据亚铁离子浓度变化计算硝酸铜的浓度.
解答:
解:(1)根据氧化性:HNO3>Fe3+>Cu2+,0~0.1段为Fe与硝酸反应,反应方程式为:Fe+4HNO3=Fe(NO3)3+NO↑+2H2O,反应的离子方程式为:Fe+NO3-+4H+=Fe3++NO↑+2H2O,故答案为:Fe+NO3-+4H+=Fe3++NO↑+2H2O;
(2)从0.2~0.3段发生反应:Fe+Cu2+═Fe2++Cu,则溶液中n[Cu(NO3)2]=△c(Fe2+)=0.8mol/L-0.6mol/l=0.2mol/L,故答案为:0.2mol/L.
(2)从0.2~0.3段发生反应:Fe+Cu2+═Fe2++Cu,则溶液中n[Cu(NO3)2]=△c(Fe2+)=0.8mol/L-0.6mol/l=0.2mol/L,故答案为:0.2mol/L.
点评:本题考查混合物计算、氧化还原反应,关键是明确反应图象中各阶段发生的反应,难度中等.

练习册系列答案
相关题目
实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
| A、950 mL 111.2 g |
| B、500 mL 117.0g |
| C、1000 mL 117.0 g |
| D、1000 mL 111.2 g |
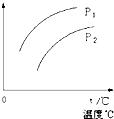 在容积一定的密闭容器中发生可逆反应Y(g)+2X(g)?2Z(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应Y(g)+2X(g)?2Z(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )| A、P1>P2,纵坐标指Y的质量分数 |
| B、P1<P2,纵坐标指X的转化率 |
| C、P1>P2,纵坐标指Z的质量分数 |
| D、P1<P2,纵坐标指混合气体的平均摩尔质量 |
生铁的熔点是1100℃~1200℃,则纯铁的熔点可能是( )
| A、1055℃ |
| B、1100℃ |
| C、1200℃ |
| D、1535℃ |
某无色溶液能与铝反应产生氢气,则在该溶液中不可能大量存在的离子组为( )
| A、Na+、Fe3+、NO3-、Cl |
| B、K+、Na+、Cl-、SO42- |
| C、K+、Ba2+、Br-、Cl- |
| D、NH4+、Na+、CO32-、PO43- |