题目内容
纳米级Cu2O由于具有优良的催化性能而受到关注,下表为制取Cu2O的四种方法:
(1)工业上常用方法c和方法d制取Cu2O,而很少用方法a,其主要原因是
(2)已知:2Cu(s)+
O2(g)=Cu2O(s);△H=-169kJ?mol-1
C(s)+
O2(g)=CO(g);△H=-110.5kJ?mol-1
Cu(s)+
O2(g)=CuO(s);△H=-157kJ?mol-1
则方法a发生的热化学方程式:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H= kJ?mol-1
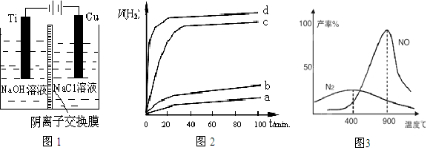
(3)方法c采用阴离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图1所示:该电池的阳极反应式为 ;钛极附近的pH值 (增大、减小、不变).
(4)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为 .
(5)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的体积V(H2)随时间t变化如图2所示.下列叙述正确的是 (填字母代号).
A.Cu2O催化水分解时,需要适宜的温度
B.c、d方法制得的Cu2O催化效率相对较高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.d方法制得的Cu2O作催化剂时,水的平衡转化率最高
(6)以上制得的Cu2O对氨气和氧气反应有一定的催化作用,且在不同温度下生成不同产物(如图3):4NH3+5O2?4NO+6H2O,4NH3+3O2?2N2+6H2O,温度较低时以生成 为主,温度高于900℃时,NO产率下降的原因是 .
| 方法a | 用炭粉在高温条件下还原CuO | ||||
| 方法b | 用葡萄糖还原新制的Cu(OH)2制备Cu2O; | ||||
| 方法c | 电解法,反应为2Cu+H2O
| ||||
| 方法d | 用肼(N2H4)还原新制Cu(OH)2 |
(2)已知:2Cu(s)+
| 1 |
| 2 |
C(s)+
| 1 |
| 2 |
Cu(s)+
| 1 |
| 2 |
则方法a发生的热化学方程式:2CuO(s)+C(s)=Cu2O(s)+CO(g)△H=
(3)方法c采用阴离子交换膜控制电解液中OH-的浓度而制备纳米Cu2O,装置如图1所示:该电池的阳极反应式为
(4)方法d为加热条件下用液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2.该制法的化学方程式为
(5)用以上四种方法制得的Cu2O在某相同条件下分别对水催化分解,产生氢气的体积V(H2)随时间t变化如图2所示.下列叙述正确的是
A.Cu2O催化水分解时,需要适宜的温度
B.c、d方法制得的Cu2O催化效率相对较高
C.催化效果与Cu2O颗粒的粗细、表面活性等有关
D.d方法制得的Cu2O作催化剂时,水的平衡转化率最高
(6)以上制得的Cu2O对氨气和氧气反应有一定的催化作用,且在不同温度下生成不同产物(如图3):4NH3+5O2?4NO+6H2O,4NH3+3O2?2N2+6H2O,温度较低时以生成

考点:用盖斯定律进行有关反应热的计算,化学电源新型电池,物质的量或浓度随时间的变化曲线
专题:化学反应中的能量变化,化学平衡专题,电化学专题
分析:(1)用炭粉在高温条件下还原CuO容易生成Cu;
(2)根据盖斯定律结合热化学方程式的书写方法来书写;
(3)在电解池的阳极发生失电子的氧化反应;钛极是阴极发生氢离子得电子的还原反应,据此分析附近pH值变化;
(4)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式;
(5)根据图象曲线的变化趋势判断,曲线斜率越大,反应速率越大,温度升高,斜率逐渐减小,以此解答;
(6)根据图象可知温度低时生成氮气,温度高时生成NO,但该反应为放热反应,则温度高于900℃时,NO产率下降.
(2)根据盖斯定律结合热化学方程式的书写方法来书写;
(3)在电解池的阳极发生失电子的氧化反应;钛极是阴极发生氢离子得电子的还原反应,据此分析附近pH值变化;
(4)根据“液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2”来书写化学方程式;
(5)根据图象曲线的变化趋势判断,曲线斜率越大,反应速率越大,温度升高,斜率逐渐减小,以此解答;
(6)根据图象可知温度低时生成氮气,温度高时生成NO,但该反应为放热反应,则温度高于900℃时,NO产率下降.
解答:
解:(1)用炭粉在高温条件下还原CuO容易生成Cu,反应不易控制生成Cu2O,故答案为:反应不易控制,易还原产生Cu;
(2)已知:①2Cu(s)+
O2(g)=Cu2O(s)△H=-169kJ?mol-1,
②C(s)+
O2(g)=CO(g)△H=-110.5kJ?mol-1,
③Cu(s)+
O2(g)═CuO(s)△H=-157kJ?mol-1
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO (s)=Cu2O(s)+CO(g),
该反应可以是②-③×2-
×①,反应的焓变是-110.5kJ?mol-1-(-157kJ?mol-1×2)-
×(-169kJ?mol-1)=34.5kJ?mol-1,
故答案为:+34.5;
(3)在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,钛极是阴极发生氢离子得电子的还原反应,所以消耗氢离子,则PH值增大,
故答案为:2Cu-2e-+2OH-=Cu2O+H2O;增大;
(4)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4
2Cu2O+N2↑+6H2O,
故答案为:4Cu(OH)2+N2H4
2Cu2O+N2↑+6H2O;
(5)A.温度升高,斜率逐渐减小,说明Cu2O催化水分解时,需要适宜的温度,故A正确;
B.c、d曲线斜率较大,说明反应速率较大,则c、d方法制得的Cu2O催化效率相对较高,故B正确;
C.用不同的方法制备的氧化亚铜的颗粒大小不同,由图象可知催化效果不同,则催化效果与Cu2O颗粒的粗细、表面活性等有关,故C正确;
D.催化剂只改变反应速率,不影响平衡移动,故D错误.
故答案为:ABC;
(6)根据图象可知温度低时生成氮气,温度高时生成NO,但该反应为放热反应,则温度高于900℃时,NO产率下降,
故答案为:N2;反应放热,温度升高NH3转化率降低.
(2)已知:①2Cu(s)+
| 1 |
| 2 |
②C(s)+
| 1 |
| 2 |
③Cu(s)+
| 1 |
| 2 |
用炭粉在高温条件下还原CuO制取Cu2O和CO的化学方程式为C(s)+2CuO (s)=Cu2O(s)+CO(g),
该反应可以是②-③×2-
| 1 |
| 2 |
| 1 |
| 2 |
故答案为:+34.5;
(3)在电解池中,当阳极是活泼电极时,该电机本身发生失电子得还原反应,在碱性环境下,金属铜失去电子的电极反应为2Cu-2e-+2OH-=Cu2O+H2O,钛极是阴极发生氢离子得电子的还原反应,所以消耗氢离子,则PH值增大,
故答案为:2Cu-2e-+2OH-=Cu2O+H2O;增大;
(4)根据题目信息:液态肼(N2H4)还原新制Cu(OH)2来制备纳米级Cu2O,同时放出N2,得出化学方程式为:4Cu(OH)2+N2H4
| ||
故答案为:4Cu(OH)2+N2H4
| ||
(5)A.温度升高,斜率逐渐减小,说明Cu2O催化水分解时,需要适宜的温度,故A正确;
B.c、d曲线斜率较大,说明反应速率较大,则c、d方法制得的Cu2O催化效率相对较高,故B正确;
C.用不同的方法制备的氧化亚铜的颗粒大小不同,由图象可知催化效果不同,则催化效果与Cu2O颗粒的粗细、表面活性等有关,故C正确;
D.催化剂只改变反应速率,不影响平衡移动,故D错误.
故答案为:ABC;
(6)根据图象可知温度低时生成氮气,温度高时生成NO,但该反应为放热反应,则温度高于900℃时,NO产率下降,
故答案为:N2;反应放热,温度升高NH3转化率降低.
点评:本题考查较为综合,涉及氧化亚铜的制备方案、电解、盖斯定律的应用、化学平衡以及反应速率的影响等知识,侧重于学生的分析能力的考查,题目难度中等.

练习册系列答案
 全优考典单元检测卷及归类总复习系列答案
全优考典单元检测卷及归类总复习系列答案 品学双优卷系列答案
品学双优卷系列答案 小学期末冲刺100分系列答案
小学期末冲刺100分系列答案
相关题目
实验室中需要配制2mol/L的NaCl溶液950mL,配制时应选用的容量瓶的规格和称取的NaCl的质量分别是( )
| A、950 mL 111.2 g |
| B、500 mL 117.0g |
| C、1000 mL 117.0 g |
| D、1000 mL 111.2 g |
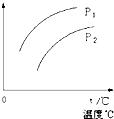 在容积一定的密闭容器中发生可逆反应Y(g)+2X(g)?2Z(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应Y(g)+2X(g)?2Z(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )| A、P1>P2,纵坐标指Y的质量分数 |
| B、P1<P2,纵坐标指X的转化率 |
| C、P1>P2,纵坐标指Z的质量分数 |
| D、P1<P2,纵坐标指混合气体的平均摩尔质量 |
生铁的熔点是1100℃~1200℃,则纯铁的熔点可能是( )
| A、1055℃ |
| B、1100℃ |
| C、1200℃ |
| D、1535℃ |
下列叙述正确的是( )
A、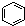 和 和 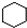 均是芳香烃, 均是芳香烃,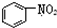 既是芳香烃又是芳香化合物 既是芳香烃又是芳香化合物 |
| B、分子式为C3H6Cl2的有机物共有5种同分异构体(不考虑立体异构) |
| C、分子式为C4H8有机物最多存在4个C-C单键 |
| D、分子式为C2H6O的红外光谱图上发现有C-H键和C-O键的振动吸收,由此可推测有机物结构简式为C2H5-OH |
下列操作中,能使电离平衡H2O?H++OH-向右移动且溶液呈酸性的是( )
| A、向水中加入NaHSO4溶液 |
| B、将水加热到100℃,使pH=6 |
| C、向水中加入Al2(SO4)3固体 |
| D、向水中加入CH3COONa固体 |
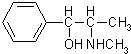 (1)药品分为处方药和非处方药.处方药是指必须在医生监控或指导下使用的药物,用符号
(1)药品分为处方药和非处方药.处方药是指必须在医生监控或指导下使用的药物,用符号