题目内容
将1.92g铜粉与一定量浓硝酸反应,当铜粉完全作用时收集到的气体与O2(标准状况)混合溶于水恰好全部转化为硝酸.则所消耗O2的体积是( )
| A、336ml |
| B、224 ml |
| C、448 ml |
| D、112 ml |
考点:氧化还原反应的计算
专题:
分析:根据电子守恒计算,已知HNO3→NO、NO2→HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,以此进行计算.
解答:
解:1.92g Cu的物质的量为n(Cu)=
=0.03mol,反应时失去电子数目为2×0.03mol=0.06mol,反应整个过程为HNO3→NO、NO2→HNO3,反应前后HNO3的物质的量不变,而化合价变化的只有铜和氧气,则Cu失去电子数目等于O2得到电子的数目,所以消耗氧气的物质的量为
n(O2)=
=0.015mol,V(O2)=0.015mol×22400ml/mol=336ml,所以通入O2的体积为336ml,
故选A.
| 1.92g |
| 64g/mol |
n(O2)=
| 0.06mol |
| 4 |
故选A.
点评:本题考查氧化还原反应电子转移数目的计算,本题难度不大,根据HNO3→NO、NO2→HNO3,得出Cu失去电子数目等于O2得到电子的数目是解答本题的关键.

练习册系列答案
相关题目
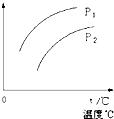 在容积一定的密闭容器中发生可逆反应Y(g)+2X(g)?2Z(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )
在容积一定的密闭容器中发生可逆反应Y(g)+2X(g)?2Z(g);△H>0,平衡移动关系如图所示.下列说法正确的是( )| A、P1>P2,纵坐标指Y的质量分数 |
| B、P1<P2,纵坐标指X的转化率 |
| C、P1>P2,纵坐标指Z的质量分数 |
| D、P1<P2,纵坐标指混合气体的平均摩尔质量 |
某温度时,Kw=1×10-12,下列说法正确的是( )
| A、pH=2的盐酸和pH=12的NaOH溶液等体积混合后,溶液的pH=7 | ||
| B、pH=11的氨水中c(OH-)=0.1mol?L-1 | ||
C、向盐酸中滴加氨水至溶液的pH=6,所得溶液中c(Cl-)>c(N
| ||
| D、将pH=4.5的盐酸稀释100倍后,溶液的pH=6.5 |
某无色溶液能与铝反应产生氢气,则在该溶液中不可能大量存在的离子组为( )
| A、Na+、Fe3+、NO3-、Cl |
| B、K+、Na+、Cl-、SO42- |
| C、K+、Ba2+、Br-、Cl- |
| D、NH4+、Na+、CO32-、PO43- |
相同温度下,容积相同的甲、乙、丙3个恒容密闭容器中发生可逆反应:2SO2(g)+O2(g)?2SO3(g)2SO3(g)△H=-197 kj?mol-1.实验测得起始、平衡时的有关数据如下表:下列叙述正确的是( )
| 起始各物质物质量/mol | 达到平衡时体系能量变化 | ||||
| SO2 | O2 | SO | Ar | ||
| 2 | 1 | 0 | 0 | 放出热量Q1 | |
| 1.8 | 0.9 | 0.2 | 0 | 放出热量Q2 | |
| 1.8 | 0.9 | 0.2 | 0.1 | 放出热量Q | |
| A、Q1=Q2=Q3=197 kJ |
| B、甲、乙、丙3个容器中反应的平衡常数不等 |
| C、达到平衡时,乙、丙容器中SO2的物质的量相等 |
| D、若在上述条件下反应生成2 mol SO3(s) 的反应热为△H1,则△H1>-197 kj?mol |
下列操作中,能使电离平衡H2O?H++OH-向右移动且溶液呈酸性的是( )
| A、向水中加入NaHSO4溶液 |
| B、将水加热到100℃,使pH=6 |
| C、向水中加入Al2(SO4)3固体 |
| D、向水中加入CH3COONa固体 |
下列有关卤素及其化合物的递变规的描述中,错误的是( )
| A、原子半径:F<Cl<Br<I |
| B、熔点:F2<Cl2<Br2<I2 |
| C、氧化性:F2>Cl2>Br2>I2 |
| D、还原性:F->Cl->Br->I- |
下列分子式表示的物质一定是纯净物的是( )
| A、C5H10 |
| B、C7H8O |
| C、CH4O |
| D、C2H4O2 |
下列有关化学用语使用正确的是( )
A、醛基的电子式: |
B、CH4Si的结构式: |
C、3,3-二甲基-1-戊烯的键线式: |
D、硝基苯的结构简式: |