题目内容
4.某同学探究外界条件对H2O2分解速率的影响,所用H2O2浓度为5%、10%,实验温度为20℃、40℃,其他试剂有1mol/L FeCl3 溶液.每次实验H2O2的用量为2mL,FeCl3溶液2滴.(1)请完成以下实验设计表:
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的 |
| ① | 20 | 5 | 无 | (Ⅰ)实验①和②探究催化剂对H2O2分解速率的影响; (Ⅱ)实验②和③探究温度对该反应速率的影响; (Ⅲ)实验②和④探究H2O2浓度对该反应速率的影响. |
| ② | 20 | 5 | FeCl3 溶液 | |
| ③ | ||||
| ④ |
(3)废旧印刷电路板的回收利用可实现资源再生.经粉碎分离,能得到非金属粉末和金属粉末.用H2O2 和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜,溶液变成蓝色,写出发生反应的化学方程式:Cu+H2O2+H2SO4 ═CuSO4+2H2O.
分析 (1)实验②和③探究温度对该反应速率的影响,故②③的温度不同,其他条件完全相同;
实验②和④探究H2O2浓度对该反应速率的影响,故②和④的H2O2浓度不同,其他条件相同;
(2)H2O2浓度增大,分解速率加快;
(3)溶液变成蓝色,说明铜被氧化成铜离子,双氧水被还原为水,据此写出反应方程式.
解答 解:(1)实验②和③要探究温度对反应速率的影响,除温度不同外,其他条件要统一,则实验③的温度为40℃,双氧水的浓度与实验②相同,为5%,并要加催化剂氯化铁;实验②和④探究H2O2浓度对该反应速率的影响,除浓度度不同外,其他条件要统一,则实验④的温度为20℃,双氧水的浓度为10%,同样要加催化剂氯化铁,
故答案为:
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的 |
| ① | ||||
| ② | ||||
| ③ | 40 | 5 | FeCl3溶液 | |
| ④ | 20 | 10 | FeCl3溶液 |
(2)实验④产生气泡的速率比实验②快,引起反应速率差异的原因是:其他条件相同时,H2O2 浓度增大,分解速率加快,
故答案为:其他条件相同时,H2O2 浓度增大,分解速率加快;
(3)溶液变成蓝色,说明铜被氧化成铜离子,双氧水被还原为水,反应方程式为:Cu+H2O2+H2SO4 ═CuSO4+2H2O,
故答案为:Cu+H2O2+H2SO4 ═CuSO4+2H2O.
点评 本题考查了探究影响化学反应速率的因素,题目难度中等,试题侧重考查学生的实验探究能力,明确实验目的为解答关键,注意掌握温度、浓度、催化剂等因素对反应速率的影响.

练习册系列答案
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案
相关题目
14.下列有关说法正确的是( )
| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的 pH=7 | |
| B. | 0.1 mol•L-1 NH4Cl 溶液与 0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol AgCl 和 0.1 mol AgI 混合后加入水中,所得溶液 c(Cl-)=c(I-) | |
| D. | 向 0.10 mol•L-1 Na2SO3溶液中通 SO2气体至溶液 pH=7:c(Na+)<2[c(SO23-)+c(HSO3-)+c(H2SO3)] |
15.某同学探究第三周期元素性质递变规律,设计了下列实验方案.
(1)请你帮助该同学完成实验报告:
(2)综合以上实验,可以得到的实验结论:S>P.
(1)请你帮助该同学完成实验报告:
| 实验内容 | 实验现象 | 有关反应的方程式或结论 |
| ①取磨光后镁条与铝条,分别投入稀盐酸中 | Mg+2HCl=MgCl2+H2↓ 2Al+6HCl=2AlCl3+3H2↓ 说明金属性的强弱顺序为:Mg>Al | |
| ②向MgCl2、AlCl3溶液中分别逐滴滴入NaOH溶液至过量 | 与MgCl2溶液反应产生白色沉淀,与AlCl3溶液反应先产生白色沉淀,而后沉淀完全溶解 | AlCl3溶液与NaOH溶液反应的化学方程式:AlCl3+3NaOH=Al(OH)3↓+3NaCl,Al(OH)3+NaOH=NaAlO2+2H2O |
| ③向新制的Na2S溶液中滴入新制的氯水 | 生成淡黄色的沉淀 | 反应的化学方程式为:Na2S+Cl2=S↓+2NaCl |
| ④向各为1mol/L的H2SO4、H3PO4溶液中投入镁条 | 镁与H2SO4反应更剧烈,迅速产生大量无色气体 | 说明非金属性的强弱顺序为:S>P |
12.一定温度下,水存在电离平衡H2O(l)?H+(aq)+OH-(aq),下列叙述一定正确的是( )
| A. | 向水中加入KHSO4溶液,平衡逆向移动,Kw减小 | |
| B. | 将水加热,Kw增大,pH减小,但还是中性 | |
| C. | 向水中加入少量CH3COONa固体,平衡逆向移动,c(H+)降低 | |
| D. | 向水中加入AlCl3溶液,平衡向右移动,KW增大 |
9.乙醇分子中各化学键如图所示对乙醇在各种反应中应断裂的键说明不正确的是( )
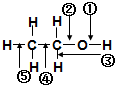

| A. | 和金属钠作用时,键②断裂 | |
| B. | 和浓硫酸共热至170℃时,键②和⑤断裂 | |
| C. | 和HBr共热时,键④断裂 | |
| D. | 在铜催化下和氧气反应时,键①和③断裂 |
13.乙醇分子结构中,各化学键如图所示.关于乙醇在各种反应中断键的说法不正确的是( )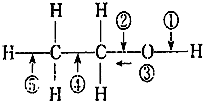

| A. | 和金属钠反应时断裂① | |
| B. | 乙醇燃烧时断裂②和⑤ | |
| C. | 在银催化条件下,与O2反应时断裂①和③ | |
| D. | 和浓H2SO4、乙酸共热时断裂①,其他键不变化 |
14.下列解释事实的方程式不正确的是( )
| A. | 测0.1mol•L-1氨水的pH为11:NH3•H2O?NH${\;}_{4}^{+}$+OH- | |
| B. | 将Na块放入水中,放出气体:2Na+2H2O=2NaOH+H2↑ | |
| C. | 铝片溶于NaOH溶液中,产生气体:2Al+2OH-+2H2O=2AlO${\;}_{2}^{-}$+3H2↑ | |
| D. | 用CuCl2溶液做导电实验,灯泡发光:CuCl2$\frac{\underline{\;电解\;}}{\;}$Cu2++2Cl- |