题目内容
19.(1)微粒间作用有多种,则CH3COONH4 不同于CuSO4•5H2O的微粒间作用有a(填字母).a.氢键 b.配位键 c.极性共价键 d.非极性共价键
(2)无水CrCl3和氨作用能形成两种配合物,组成相当于CrCl3•6NH3及CrCl3•5NH3,加入AgNO3溶液能从第一种配合物水溶液中将几乎所有的氯沉淀为AgCl,而从第二种配合物水溶液中仅能沉淀出相当于组成中含氯量2/3的AgCl,加入NaOH并加热时两种溶液都无味.则两种配合物的化学式分别为:[Cr(NH3)6]Cl3、[CrCl(NH3)5]Cl2.
(3)硝化甘油(C3H5N3O9)分解的产物为N2、CO2、O2和H2O,已知20℃时,2.27g硝化甘油分解放出热量为15.4kJ,则其热化学方程式为4C3H5N3O9 (l)=6N2(g)+12CO2(g)+O2(g)+10H2O(l)△H=-6160KJ/mol,每生成1mol气体伴随放出的热量为324.2kJ.
分析 (1)氢键是一种特殊的分子间作用力,非化学键,N、O、F元素的电负性较强,对应的氢化物或含氢化合物可形成氢键,一般来说,不同非金属元素之间存在极性共价键;同种非金属元素之间易形成非极性共价键;CuSO4•5H2O为配合物,配合物形式为[Cu(H2O)4]SO4•H2O,CH3COONH4为离子化合物,铵根离子中含有配位键;
(2)络合物由內界和外界组成,络合物溶于水发生电离生成內界离子(络离子)和外界离子,与AgNO3溶液反应的离子肯定为外界离子,加入NaOH并加热时两种溶液都无味,说明NH3在内界;
(3)利用观察法配平方程式;根据方程式可知,每摩尔硝化甘油分解产生的气体,由此计算出0.1mol硝化甘油分解产生气体,根据2.27g硝化甘油分解放出热量为15.4kJ,可列比例计算4mol硝化甘油分解放出的热量,结合热化学方程式书写方法写出,根据热化学方程式,可求出生成1mol气体放出的热量.
解答 解:(1)CH3COONH4为离子化合物,铵根离子中氮提供孤对电子,氢离子提供空轨道,存在配位键,N-H、C-H、C-O为极性共价键,无氢键、非极性共价键,
CuSO4•5H2O为配合物,配合物形式为[Cu(H2O)4]SO4•H2O,存在离子键([Cu(H2O)4]2+、SO42-)、配位键((Cu2+、H2O)、氢键([Cu(H2O)4]SO4与H2O之间)以及极性共价键(不同非金属元素之间),所以CH3COONH4 不同于CuSO4•5H2O的微粒间作用有氢键,
故答案为:a;
(2)络合物由內界和外界组成,与AgNO3溶液反应的离子肯定为外界离子,第一种CrCl3•6NH3配合物中加入AgNO3溶液能从第一种配合物水溶液中将几乎所有的氯沉淀为AgCl,说明氯都存在于外界,第二种配合物水溶液中仅能沉淀出相当于组成中含氯量2/3的AgCl,说明氯只有2/3在外界;加入NaOH加热时两种溶液都没有NH3产生,因此两种配合物中NH3的都在内界,所以两种配合物的化学式分别为:[Cr(NH3)6]Cl3、[CrCl(NH3)5]Cl2,
故答案为:[Cr(NH3)6]Cl3、[CrCl(NH3)5]Cl2;
(3)硝化甘油(C3H5N3O9)分解时产物为N2、CO2、O2和H2O,配平方程式得:4C3H5N3O9$\frac{\underline{\;\;△\;\;}}{\;}$6N2+12CO2+O2+10H2O;硝化甘油的摩尔质量为227g/mol,
2.27g硝化甘油的物质的量为$\frac{2.27g}{227g/mol}$=0.01mol,放出15.4KJ能量,4mol硝化甘油(C3H5N3O9)分解时放出热量=$\frac{15.4×4}{0.01}$KJ=6160KJ,
反应的热化学方程式为:4C3H5N3O9 (l)=6N2(g)+12CO2(g)+O2(g)+10H2O(l)△H=-6160KJ/mol,
2.27g硝化甘油的物质的量为0.01mol,生成气体$\frac{19}{4}$×0.01=0.0475mol,放出15.4KJ能量,
则生成1mol气体放出的热量为:$\frac{15.4KJ}{0.0475}$=324.2KJ,
故答案为:4C3H5N3O9=6N2+12CO2+O2+10H2O;4C3H5N3O9 (l)=6N2(g)+12CO2(g)+O2(g)+10H2O(l)△H=-6160KJ/mol;324.2.
点评 本题考查了配合物的组成及性质、反应热的计算,明确化学键的类型、配合物的电离方式、热化学方程式的意义是解本题的关键,题目难度中等.

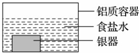 银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是
银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是( )
| A. | 该处理过程中电能转化为化学能 | B. | 银器为正极,Ag2S 还原为单质银 | ||
| C. | 铝质容器为阳极,其质量变轻 | D. | Ag2S 溶解于食盐水生成了 AgCl |
| A. | v(B2)=4.8 mol/(L•min) | B. | v(A2)=1.5 mol/(L•s) | ||
| C. | v(C)=1.6 mol/(L•s) | D. | v(B2)=1.7 mol/(L•s) |
| A. | PH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 由水电离出的C(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 无色溶液中:Cu2+、Al3+、NH4+、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Fe2+、NH4+、AlO2-、S2- |
| A. | KHCO3 | B. | AlCl3 | C. | Na2SO3 | D. | Fe2(SO4)3 |
(1)请完成以下实验设计表:
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的 |
| ① | 20 | 5 | 无 | (Ⅰ)实验①和②探究催化剂对H2O2分解速率的影响; (Ⅱ)实验②和③探究温度对该反应速率的影响; (Ⅲ)实验②和④探究H2O2浓度对该反应速率的影响. |
| ② | 20 | 5 | FeCl3 溶液 | |
| ③ | ||||
| ④ |
(3)废旧印刷电路板的回收利用可实现资源再生.经粉碎分离,能得到非金属粉末和金属粉末.用H2O2 和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜,溶液变成蓝色,写出发生反应的化学方程式:Cu+H2O2+H2SO4 ═CuSO4+2H2O.
| A. | CO2的电子式: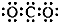 | |
| B. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| C. | NH4Cl的电子式: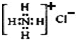 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
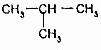 的关系是同系物
的关系是同系物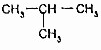 (异丁烷)的关系是同分异构体.
(异丁烷)的关系是同分异构体.