题目内容
14.下列有关说法正确的是( )| A. | 同浓度、同体积的强酸与强碱溶液混合后,溶液的 pH=7 | |
| B. | 0.1 mol•L-1 NH4Cl 溶液与 0.1 mol•L-1氨水等体积混合(pH>7):c(NH3•H2O)>c(NH4+)>c(Cl-)>c(OH-) | |
| C. | 0.1 mol AgCl 和 0.1 mol AgI 混合后加入水中,所得溶液 c(Cl-)=c(I-) | |
| D. | 向 0.10 mol•L-1 Na2SO3溶液中通 SO2气体至溶液 pH=7:c(Na+)<2[c(SO23-)+c(HSO3-)+c(H2SO3)] |
分析 A.酸碱的元数不知同浓度、同体积的强酸与强碱溶液混合后溶液不一定为中性;
B.0.1 mol•L-1 NH4Cl 溶液与 0.1 mol•L-1氨水等体积混合,溶液PH>7溶液显碱性,一水合氨电离大于铵根离子水解;
C.AgCl与AgI的溶度积不同,所得溶液中c(Cl-)≠c(I-);
D.溶液呈中性有c(H-)=c(OH-),结合电荷守恒有c(H-)+c(Na+)=2c(SO32-)+c(HSO3-)+-c(OH-),分析;
解答 解:A.酸碱的元数不知同浓度、同体积的强酸与强碱溶液混合后溶液不一定为中性,氢氧化钠和硫酸等浓度等体积混合反应后溶液显酸性,故A错误;
B.0.1 mol•L-1 NH4Cl 溶液与 0.1 mol•L-1氨水等体积混合,溶液PH>7溶液显碱性,一水合氨电离大于铵根离子水解,c(NH4+)>c(NH3•H2O)>c(Cl-)>c(OH-),故B错误;
C.均存在溶解平衡,溶液中Ag+浓度相同,AgCl与AgI的溶度积不同,所得溶液中c(Cl-)≠c(I-),故C错误;
D.向 0.10 mol•L-1 Na2SO3溶液中通 SO2气体至溶液 pH=7,溶液呈中性有c(H-)=c(OH-),结合电荷守恒有c(H-)+c(Na+)=2c(SO32-)+c(HSO3-)+-c(OH-),c(Na+)=2c(SO32-)+c(HSO3-),c(Na+)<2[c(SO23-)+c(HSO3-)+c(H2SO3)],故D正确;
故选D.
点评 本题考查了离子浓度大小比较、溶液中电荷守恒、溶度积常数、盐类水解和弱电解质电离平衡影响因素等知识点,题目难度中等.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
5.1mol下列物质在标准状况下体积为22.4L的是( )
| A. | 水蒸气 | B. | 溴蒸气 | C. | 三氧化硫气体 | D. | 一氧化氮气体 |
2.和田玉在我国至少有7000年的历史,也称为软玉,是我国玉文化的主体.和田玉是一种具有链状结构的含水钙镁硅酸盐,某种和田玉的化学成分为Ca2Mg3Fe2(Si4O11)2(OH)2,下列有关叙述正确的是( )
| A. | 其化学式改写为氧化物的形式为2CaO•3MgO•Fe2O3•8SiO2•H2O | |
| B. | 它能够抵抗任何酸碱的腐蚀 | |
| C. | 其中铁元素的化合价为+3 | |
| D. | 其中铁元素的化合价为+2 |
9.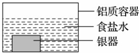 银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是
银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是
( )
 银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是
银制器皿表面日久因生成 Ag2S 而变黑,可进行如下处理:将表面发黑的银器浸入盛有食盐水的铝质容器中(如图),一段时间后黑色褪去.有关说法正确的是( )
| A. | 该处理过程中电能转化为化学能 | B. | 银器为正极,Ag2S 还原为单质银 | ||
| C. | 铝质容器为阳极,其质量变轻 | D. | Ag2S 溶解于食盐水生成了 AgCl |
3.有机物A无色粘稠液体,易溶于水.为研究A的组成与结构,进行了如下实验:
| 实 验 步 骤 | 解 释 或 实 验 结 论 |
| (1)称取A 9.0g,升温使其汽化,测其密度是相同条件下H2的45倍. | 试通过计算填空:(1)A的摩尔质量为:90. |
| (2)将此9.0g A在足量纯O2充分燃烧,并使其产物依次缓缓通过浓硫酸、碱石灰,发现分别增重5.4g和13.2g. | (2)A的分子式为 :C3H6O3. |
| (3)另取A 9.0g,跟足量的NaHCO3粉末反应,生成2.24L CO2(标准状况),若与足量金属钠反应则生成2.24L H2(标准状况). | (3)A中含有官能团的名称: 羧基、羟基. |
(4)A的核磁共振氢谱如图: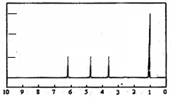 | (4)A中含有1个手性碳原子. |
(5)综上所述,A的结构简式为: . . | |
4.某同学探究外界条件对H2O2分解速率的影响,所用H2O2浓度为5%、10%,实验温度为20℃、40℃,其他试剂有1mol/L FeCl3 溶液.每次实验H2O2的用量为2mL,FeCl3溶液2滴.
(1)请完成以下实验设计表:
(2)实验④产生气泡的速率比实验②快.分析引起反应速率差异的原因是其他条件相同时,H2O2浓度增大,分解速率加快.
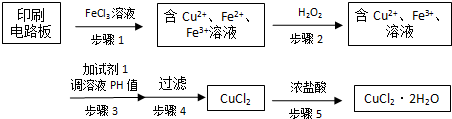
(3)废旧印刷电路板的回收利用可实现资源再生.经粉碎分离,能得到非金属粉末和金属粉末.用H2O2 和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜,溶液变成蓝色,写出发生反应的化学方程式:Cu+H2O2+H2SO4 ═CuSO4+2H2O.
(1)请完成以下实验设计表:
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的 |
| ① | 20 | 5 | 无 | (Ⅰ)实验①和②探究催化剂对H2O2分解速率的影响; (Ⅱ)实验②和③探究温度对该反应速率的影响; (Ⅲ)实验②和④探究H2O2浓度对该反应速率的影响. |
| ② | 20 | 5 | FeCl3 溶液 | |
| ③ | ||||
| ④ |
(3)废旧印刷电路板的回收利用可实现资源再生.经粉碎分离,能得到非金属粉末和金属粉末.用H2O2 和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜,溶液变成蓝色,写出发生反应的化学方程式:Cu+H2O2+H2SO4 ═CuSO4+2H2O.
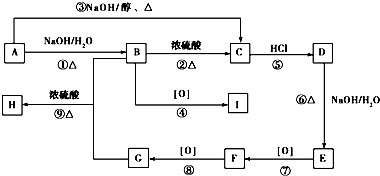
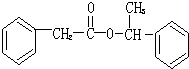 .
. .
. ,用化学方程式表示检验 F 中官能团的常用方法
,用化学方程式表示检验 F 中官能团的常用方法 .
.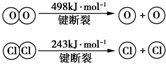 用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$Cl2+H2O,已知:反应A中,4mol HCl被氧化,放出115.6kJ的热量.
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$Cl2+H2O,已知:反应A中,4mol HCl被氧化,放出115.6kJ的热量.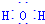 .
.