题目内容
9.乙醇分子中各化学键如图所示对乙醇在各种反应中应断裂的键说明不正确的是( )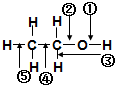
| A. | 和金属钠作用时,键②断裂 | |
| B. | 和浓硫酸共热至170℃时,键②和⑤断裂 | |
| C. | 和HBr共热时,键④断裂 | |
| D. | 在铜催化下和氧气反应时,键①和③断裂 |
分析 A.与Na反应生成氢气,O-H键断裂;
B.共热至170℃时生成乙烯,C-O和C-H键断裂;
C.和HBr共热时,发生取代反应生成溴乙烷;
D.在Cu催化下与O2反应时,生成醛,C-H、O-H键断裂.
解答 解:A.与Na反应生成氢气,O-H键断裂,即①断裂,故A错误;
B.共热至170℃时生成乙烯,C-O和C-H键断裂,键②、⑤键断裂,故B正确;
C.和HBr共热时,反应生成溴代乙烷,C-O键断裂,即②键断裂,故C错误;
D.在Cu催化下与O2反应时,生成醛,C-H、O-H键断裂,则键①、③断裂,故D正确;
故选AC.
点评 本题考查有机物的结构与性质,侧重乙醇性质的考查,注意乙醇的性质与官能团、化学键的关系,注重基础知识的考查,题目难度不大.

练习册系列答案
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案
相关题目
20.反应2A(g)?2B(g)+E(g)(吸热反应)达到平衡时,要使正反应速率降低,A的浓度增大,可采取的措施是( )
| A. | 加压 | B. | 减压 | C. | 降温 | D. | 减少E的浓度 |
4.某同学探究外界条件对H2O2分解速率的影响,所用H2O2浓度为5%、10%,实验温度为20℃、40℃,其他试剂有1mol/L FeCl3 溶液.每次实验H2O2的用量为2mL,FeCl3溶液2滴.
(1)请完成以下实验设计表:
(2)实验④产生气泡的速率比实验②快.分析引起反应速率差异的原因是其他条件相同时,H2O2浓度增大,分解速率加快.
(3)废旧印刷电路板的回收利用可实现资源再生.经粉碎分离,能得到非金属粉末和金属粉末.用H2O2 和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜,溶液变成蓝色,写出发生反应的化学方程式:Cu+H2O2+H2SO4 ═CuSO4+2H2O.
(1)请完成以下实验设计表:
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的 |
| ① | 20 | 5 | 无 | (Ⅰ)实验①和②探究催化剂对H2O2分解速率的影响; (Ⅱ)实验②和③探究温度对该反应速率的影响; (Ⅲ)实验②和④探究H2O2浓度对该反应速率的影响. |
| ② | 20 | 5 | FeCl3 溶液 | |
| ③ | ||||
| ④ |
(3)废旧印刷电路板的回收利用可实现资源再生.经粉碎分离,能得到非金属粉末和金属粉末.用H2O2 和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜,溶液变成蓝色,写出发生反应的化学方程式:Cu+H2O2+H2SO4 ═CuSO4+2H2O.
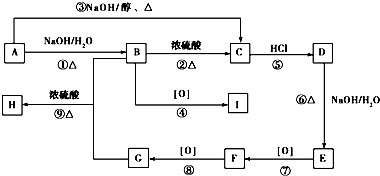
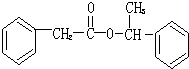 .
. .
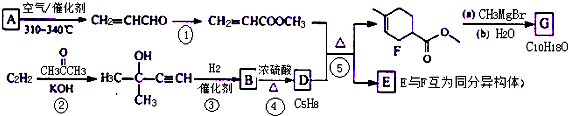
. ,用化学方程式表示检验 F 中官能团的常用方法
,用化学方程式表示检验 F 中官能团的常用方法 .
.
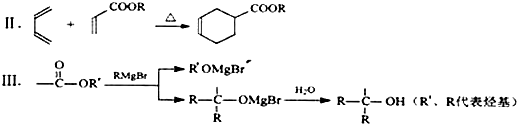
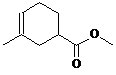 、
、
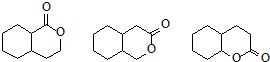 (其中任意一种).
(其中任意一种).