题目内容
16.过氧化钙是一种安全无毒的物质,常带有数量不等的结晶水,由于长时间放置,通常还含有部分CaO,为测定样品中过氧化钙的组成与含量,进行如下实验:(1)称取0.542g某过氧化钙样品,灼热时发生如下反应:2CaO2•XH2O $\stackrel{加热}{→}$2CaO+O2↑+2XH2O.在标准状况下得到的O2体积为67.2mL,求该样品中CaO2的物质的量为0.006mol
(2)另取同一样品0.542g,溶于适量的稀盐酸中,然后加入足量的Na2CO3溶液,将溶液中Ca2+全部转化为CaCO3沉淀,得到干燥的CaCO3 0.700g.
①计算样品中CaO2•XH2O的X值.
②若用化学式表示该样品的组成,应表示为CaO•6CaO2•3H2O.
分析 (1)首先计算氧气的物质的量,根据方程式计算CaO2的物质的量;
(2)根据CaCO3沉淀的质量可得样品中Ca元素的质量,根据Ca元素质量守恒计算CaO的质量,总质量减去CaO2和CaO的质量即得水的质量,进而计算H2O和CaO2的物质的量比值,即可得到x的值.
解答 解:(1)n(O2)=$\frac{0.0672L}{22.4L/mol}$=0.003mol,
2(CaO2•xH2O)$\frac{\underline{\;\;△\;\;}}{\;}$2CaO+O2↑+2xH2O
2mol 1mol
n(CaO2•xH2O) 0.003mol
n(CaO2•xH2O)=0.006mol,
则n(CaO2)=n(CaO2•xH2O)=0.006mol,
故答案为:0.006mol;
(2)n(CaCO3)=$\frac{0.70g}{100g/mol}$=0.007mol,
①样品中水的质量为:m(H2O)=0.542g-m(CaO2)-m(CaO)=0.542g-0.006mol×72g/mol-0.056g=0.054g,n(H2O)=$\frac{0.054g}{18g/mol}$=0.003mol,
x=$\frac{n({H}_{2}O)}{n(Ca{O}_{2})}$=$\frac{0.003mol}{0.006mol}$=0.5,
n(H2O)=$\frac{0.054g}{18g/mol}$=0.003mol,
x=$\frac{n({H}_{2}O)}{n(Ca{O}_{2})}$=$\frac{0.003mol}{0.006mol}$=0.5,
答:样品中CaO2•xH2O的x值为0.5;
②根据Ca元素守恒,可知:n(CaO)=0.007mol-0.006mol=0.001mol,
所以样品的组成为:CaO•6CaO2•3H2O,
故答案为:CaO•6CaO2•3H2O.
点评 本题考查混合物的计算,题目难度中等,注意根据反应的化学方程式,从质量守恒的角度计算.

| A. | PH=1的溶液中:Na+、K+、MnO4-、CO32- | |
| B. | 由水电离出的C(H+)=1×10-13mol•L-1的溶液中:Mg2+、Cu2+、SO42-、NO3- | |
| C. | 无色溶液中:Cu2+、Al3+、NH4+、Cl- | |
| D. | 0.1 mol•L-1FeCl3溶液中:Fe2+、NH4+、AlO2-、S2- |
(1)请完成以下实验设计表:
| 实验编号 | 温度/℃ | H2O2浓度/% | 其它试剂 | 实验目的 |
| ① | 20 | 5 | 无 | (Ⅰ)实验①和②探究催化剂对H2O2分解速率的影响; (Ⅱ)实验②和③探究温度对该反应速率的影响; (Ⅲ)实验②和④探究H2O2浓度对该反应速率的影响. |
| ② | 20 | 5 | FeCl3 溶液 | |
| ③ | ||||
| ④ |
(3)废旧印刷电路板的回收利用可实现资源再生.经粉碎分离,能得到非金属粉末和金属粉末.用H2O2 和H2SO4 的混合溶液可溶出印刷电路板金属粉末中的铜,溶液变成蓝色,写出发生反应的化学方程式:Cu+H2O2+H2SO4 ═CuSO4+2H2O.
| A. | Na+ | B. | SO42- | C. | S 2- | D. | NH4+ |
| A. | CO2的电子式: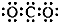 | |
| B. | 质量数为37的氯原子:${\;}_{37}^{17}$Cl | |
| C. | NH4Cl的电子式: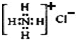 | |
| D. | 原子核内有10个中子的氧原子:${\;}_{8}^{18}$O |
| A. | 用96%的工业酒精制取无水乙醇,可采用的方法是加生石灰,再蒸馏 | |
| B. | 在组装蒸馏装置时,温度计的水银球应伸入液面下 | |
| C. | 在苯甲酸重结晶实验中,粗苯甲酸加热溶解后还要加少量蒸馏水 | |
| D. | 在苯甲酸重结晶实验中,待粗苯甲酸完全溶解后要冷却到常温才过滤 |
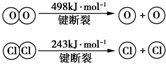 用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$Cl2+H2O,已知:反应A中,4mol HCl被氧化,放出115.6kJ的热量.
用Cl2生产某些含氯有机物时会产生副产物HCl.利用反应A,可实现氯的循环利用.反应A:4HCl+O2$\frac{\underline{\;CuO/CuCl_{2}\;}}{400℃}$Cl2+H2O,已知:反应A中,4mol HCl被氧化,放出115.6kJ的热量.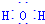 .
.
 .
.