题目内容
8.将0.2mol某烷烃完全燃烧后,生成的气体缓缓通过0.5L 2mol/L的NaOH溶液中,生成正盐和酸式盐的物质的量之比为1:3,则该烷烃是( )| A. | 甲烷 | B. | 乙烷 | C. | 丙烷 | D. | 丁烷 |
分析 正盐为碳酸钠、酸式盐为碳酸氢钠,根据钠原子守恒计算出碳酸钠、碳酸氢钠的物质的量,再根据C原子守恒计算出生成二氧化碳的物质的量,然后根据烃的物质的量、二氧化碳的物质的量可确定该烷烃的分子式.
解答 解:设Na2CO3物质的量为xmol,NaHCO3物质的量为3xmol,
由Na元素守恒得:n(Na+)=n(NaOH)=n(NaHCO3)+2n(Na2CO3),即:2x+3x=0.5L×2mol/L=1mol,
解得:x=0.2 mol,
由C元素守恒得:n(CO2)=x+3x=0.8 mol,
CnH2n+2~nCO2
1 n
0.2 mol 0.8 mol
n=$\frac{0.8mol×1}{0.2mol}$=4,
该烷烃分子中含有4个C,为丁烷,
故选D.
点评 本题考查烃燃烧的有关计算,侧重于学生的分析、计算能力的考查,题目难度中等,注意掌握确定有机物分子式的方法,本题采取守恒计算,简化计算,注意守恒思想在计算中的运用.

练习册系列答案
相关题目
18.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 在由水电离出的c(H+)=1×10-12mol/L的溶液中:Fe2+、ClO-、Na+、SO42- | |
| B. | 在使红色石蕊试纸变蓝的溶液中:SO32-、CO32-、Na+、K+ | |
| C. | 在含有大量Fe3+的溶液中:Cu2+、Cl-、NO3-、S2- | |
| D. | 有较多Fe3+的溶液中:Na+、NH4+、SCN-、HCO3- |
3.下列各组烃中,所取质量一定时,无论以何样的比例混合,燃烧生成的CO2为一定值的是( )
| A. | 乙烯和环丙烷 | B. | 甲烷和乙烷 | C. | 丙烯和丙烷 | D. | 丙烷和环丙烷 |
13.银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O═2Ag+Zn(OH)2,下列说法中不正确的是( )
| A. | 原电池放电时,负极上发生反应的物质是Zn | |
| B. | 负极发生的反应是Zn+2OH--2e-═Zn(OH)2 | |
| C. | 工作时,负极区溶液碱性减弱,正极区溶液碱性增强 | |
| D. | 溶液中OH-向正极移动,K+、H+向负极移动 |
20.能正确表示下列反应的离子方程式的是( )
| A. | 将Cl2通入氯化亚铁溶液:Fe2++Cl2═Fe3++2Cl- | |
| B. | 氯气通入水中:Cl2+H2O═2H++Cl-+ClO- | |
| C. | 向硝酸亚铁溶液中加入稀硫酸:Fe2++4H++NO3-═Fe3++NO↑+2H2O | |
| D. | 往水玻璃中通入少量二氧化碳:SiO32-+H2O+CO2═H2SiO3↓+CO32- |
17.甲烷和Cl2在光照条件下发生反应生成的产物最多的是( )
| A. | CH3Cl | B. | HCl | C. | CH2Cl2 | D. | CHCl3 |
18. 下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
 下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 最高价氧化物对应水化物的酸性Y>Z>W | |
| B. | WO2可使酸性高锰酸钾褪色,说明WO2有漂白性 | |
| C. | ZCl4电子式: | |
| D. | X的气态氢化物可与W的最高价氧化物对应水化物相互反应生成离子化合物 |
 已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.
已知硫酸铜在加热条件下发生分解反应,生成氧化铜、二氧化硫、三氧化硫和氧气.请用如图所示装置,测定硫酸铜在加热分解时产生的各物质与参加反应的硫酸铜的物质的量的关系.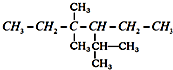 系统命名:2,4,4-三甲基-3-乙基己烷.
系统命名:2,4,4-三甲基-3-乙基己烷. 的系统名称3-甲基-2-乙基-1-丁烯,将其在催化剂存在下完全氢化所得烷烃的系统名称是2,3-二甲基戊烷.
的系统名称3-甲基-2-乙基-1-丁烯,将其在催化剂存在下完全氢化所得烷烃的系统名称是2,3-二甲基戊烷.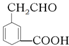 碳碳双键、醛基、羧基.
碳碳双键、醛基、羧基.