题目内容
3.某碱金属1.15g与足量水反应,得到标准状况下0.56L氢气,则该金属是( )| A. | Li | B. | Na | C. | K | D. | Rb |
分析 标准状况下的H20.56L,氢气的物质的量为$\frac{0.56L}{22.4L/mol}$=0.025mol,结合电子守恒计算相对原子质量,由此分析解答.
解答 解:标准状况下的H20.56L,氢气的物质的量为$\frac{0.56L}{22.4L/mol}$=0.025mol,所以转移电子的物质的量为:0.025mol×2=0.05mol,所以电子摩尔质量为:$\frac{1.15g}{0.05mol}$=23g/mol,所以该金属为钠,故选B.
点评 本题考查化学反应方程式的计算,为高频考点,把握碱金属与水的反应及电子守恒为解答的关键,侧重分析与计算能力的考查,题目难度不大.

练习册系列答案
 千里马走向假期期末仿真试卷寒假系列答案
千里马走向假期期末仿真试卷寒假系列答案
相关题目
13.银锌电池广泛用作各种电子仪器的电源,其电极分别为Ag2O和Zn,电解质溶液为KOH溶液,总反应为Ag2O+Zn+H2O═2Ag+Zn(OH)2,下列说法中不正确的是( )
| A. | 原电池放电时,负极上发生反应的物质是Zn | |
| B. | 负极发生的反应是Zn+2OH--2e-═Zn(OH)2 | |
| C. | 工作时,负极区溶液碱性减弱,正极区溶液碱性增强 | |
| D. | 溶液中OH-向正极移动,K+、H+向负极移动 |
18. 下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
 下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 最高价氧化物对应水化物的酸性Y>Z>W | |
| B. | WO2可使酸性高锰酸钾褪色,说明WO2有漂白性 | |
| C. | ZCl4电子式: | |
| D. | X的气态氢化物可与W的最高价氧化物对应水化物相互反应生成离子化合物 |
15.常温下,A溶液的PH=6,B溶液的[OH-]=10-10mol/L,C溶液的[H+]=10-1mol/L,三种溶液的酸性由强到弱的顺序是( )
| A. | ABC | B. | CBA | C. | BCA | D. | BAC |
12.下列事实不能用键能的大小来解释的是( )
| A. | N元素的电负性较大,但N2的化学性质很稳定 | |
| B. | 稀有气体一般难发生反应 | |
| C. | HF、HCl、HBr、HI的稳定性逐渐减弱 | |
| D. | F2比O2更容易与H2反应 |
13.下列物质中属于电解质且能导电的是( )
| A. | 稀盐酸 | B. | 硫酸铜溶液 | C. | 酒精 | D. | 氯化钠(熔融) |
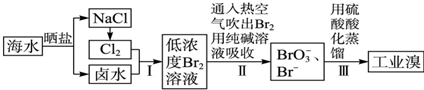

 ;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”).
;该物质溶于水后的溶液呈碱性(填“酸”、“碱”或“中”). .
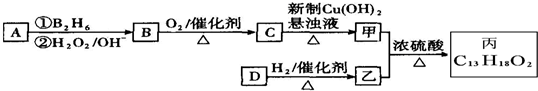
.
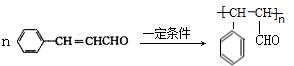 .
. .
. .
.