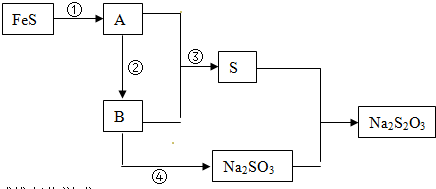
题目内容
13.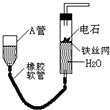 如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:
如图的实验装置可用于实验室中制取乙炔及成份检验.请回答下列问题:(1)制取乙炔的化学方程式为CaC2+2H2O=Ca(OH)2+C2H2↑.
(2)将制得的乙炔通入酸性KMnO4溶液中可观察溶液紫红色褪去,这是由于乙炔发生了氧化反应.
(3)将制得的乙炔通入足量的溴的四氯化碳溶液,写出相关的化学方程式CH≡CH+2Br2→CHBr2-CHBr2.
(4)为了安全,乙炔气体在点燃前应验纯,乙炔燃烧时的现象是明亮的火焰,并伴有大量的浓烟.
(5)验证电石与水反应生成的乙炔和溴发生加成反应,下列叙述正确的是a、c.
a.使溴水褪色的反应,未必是加成反应
b.使溴水褪色的反应,就是加成反应
c.使溴水褪色的物质,未必是乙炔
d.使溴水褪色的物质,就是乙炔.
分析 (1)碳化钙与水反应生成氢氧化钙和乙炔;
(2)酸性KMnO4具有强氧化性,乙炔含有碳碳三键,具有还原性;
(3)乙炔含有碳碳三键,为不饱和烃,能与溴单质发生加成反应;
(4)依据可燃气体燃烧前应先验纯,乙炔含碳量高分析燃烧的现象;
(5)能与溴发生反应的有苯酚、不饱和烃等,生成的乙炔含有硫化氢,可与溴发生氧化还原反应.
解答 解:(1)碳化钙与水反应的化学方程式为:CaC2+2H2O=Ca(OH)2+C2H2↑,故答案为:CaC2+2H2O=Ca(OH)2+C2H2↑;
(3)乙炔含有碳碳三键,具有还原性,能被酸性的高锰酸钾氧化,故答案为:氧化;
(3)乙炔含有碳碳三键,为不饱和烃,能与溴的四氯化碳溶液中的溴单质发生加成反应使其褪色,反应为:CH≡CH+2Br2→CHBr2-CHBr2,
故答案为:CH≡CH+2Br2→CHBr2-CHBr2;
(4)可燃气体燃烧前应先验纯,乙炔含碳量高,燃烧时产生明亮的火焰伴有浓黑烟,方程式为:2 C2H2+5 O2$\stackrel{点燃}{→}$4CO2+2H2O,
故答案为:验纯;明亮的火焰,并伴有大量的浓烟;
(5)生成的乙炔中往往混有硫化氢等气体,可与溴发生氧化还原反应而使溶液褪色,则a、cC正确,b、d错误,
故答案为:a、c.
点评 本题以乙炔的实验室制法为载体考查了乙炔的性质,明确制备乙炔的原理和乙炔的结构式解题的关键,题目难度不大.

练习册系列答案
 优等生题库系列答案
优等生题库系列答案
相关题目
3.下列各组烃中,所取质量一定时,无论以何样的比例混合,燃烧生成的CO2为一定值的是( )
| A. | 乙烯和环丙烷 | B. | 甲烷和乙烷 | C. | 丙烯和丙烷 | D. | 丙烷和环丙烷 |
4.下列化合物中,不能由单质直接化合而得到的是( )
| A. | FeCl2 | B. | Na2O2 | C. | FeS | D. | Fe3O4 |
18. 下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
 下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )
下表为元素周期表的一部分,X、Y、Z、W均为短周期元素,其中W原子的最外层电子数是最内层电子数的3倍.下列判断正确的是( )| A. | 最高价氧化物对应水化物的酸性Y>Z>W | |
| B. | WO2可使酸性高锰酸钾褪色,说明WO2有漂白性 | |
| C. | ZCl4电子式: | |
| D. | X的气态氢化物可与W的最高价氧化物对应水化物相互反应生成离子化合物 |
3.由甲醛、乙炔和苯组成的混合物中,测得含碳元素的质量分数为72%,则混合物中氢元素的质量分数为( )
| A. | 20.7% | B. | 22% | C. | 1.3% | D. | 7.3% |
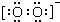 ;
;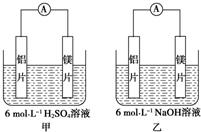 甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.
甲、乙两位学生想利用原电池反应检测金属的活动性顺序,两人均使用镁片与铝片作电极,但甲同学将电极放入6mol•L-1H2SO4溶液中,乙同学将电极放入6mol•L-1的NaOH溶液中,如图所示.