题目内容
6.有A、B、C、D、E五种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数,B原子最外层中有两个未成对的电子,D、E原子核内各自的质子数与中子数相等,B元素可分别与A、C、D、E生成RB2型化合物,并已知在DB2和EB2中,D与B的质量比为7:8,E与B的质量比为1:1.根据以上条件,用化学用语回答下列问题:
(1)写出D原子的电子排布式1s22s22p63s23p2.
(2)E元素与钠元素形成一种含有非极性键的离子化合物,电子式为

(3)分子式为AB的化合物中,σ键与π键的比值是1:2.
(4)比较B、C、D三种元素的第一电离能的大小顺序N>O>Si(由大到小的顺序排列).
(5)C与D形成的化合物化学式是Si3N4,1mol该化合物含有化学键的数目是4NA
(6)温度一定时,在体积为V的密闭容器中,装入一定量CB2达到平衡,再将容器体积缩小,再次达平衡,混合气体的平均相对分子质量将增大(填“增大”、“减小”或“不变”)
分析 p能级电子数不超过6,A原子最外层p能级的电子数等于次外层的电子数总数,则A的核外电子排布为1s22s22p2,应为C元素,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,为O元素,B元素可分别与A、C、D、E生成RB2型化合物,且A、B、C属于同一周期,则C为N元素,可形成NO2化合物,在DB2和EB2中,D与B的质量比为7:8,则有M(D):M(O)=7:4,M(D)=7×$\frac{16}{4}$=28,D应为Si元素;E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素,结合元素对应原子的结构、单质以及化合物的性质解答该题.
解答 解:p能级电子数不超过6,A原子最外层p能级的电子数等于次外层的电子数总数,则A的核外电子排布为1s22s22p2,应为C元素,B原子最外层中有两个不成对的电子,核外电子排布式为1s22s22p4,为O元素,B元素可分别与A、C、D、E生成RB2型化合物,且A、B、C属于同一周期,则C为N元素,可形成NO2化合物,在DB2和EB2中,D与B的质量比为7:8,则有M(D):M(O)=7:4,M(D)=7×$\frac{16}{4}$=28,D应为Si元素;E与B的质量比为1:1,则M(E)=2M(O)=2×16=32,所以E为S元素,
(1)D为Si元素,原子序数为14,基态原子的核外电子排布式为1s22s22p63s23p2,
故答案为:1s22s22p63s23p2;
(2)B元素与钠元素形成一种含有非极性键的离子化合物为过氧化钠,电子式为 ,
,
故答案为: ;
;
(3)分子式为CO的化合物中,CO和氮气是等电子体,其结构相似,所以CO中σ键与π键的比值是1:2,
故答案为:1:2;
(4)B、C、D三种元素分别是O、N、Si元素,同一周期元素,元素的第一电离能随着原子序数增大而增大,但第IIA族、第VA族元素第一电离能大于其相邻元素,同一主族元素,其第一电离能随着原子序数增大而减小,所以这三种元素的第一电离能的大小顺序N>O>Si,故答案为:N>O>Si;
(5)C与D形成的化合物化学式是Si3N4,1个Si原子连接4个Si-N键,则1mol该化合物含有化学键的数目是 4NA,
故答案为:Si3N4;4NA;
(6)温度一定时,在体积为V的密闭容器中,装入一定量CB2达到平衡,存在平衡2NO2(g)?N2O4(g),再将容器体积缩小,再次达平衡,减小体积增大压强,平衡正向移动,混合气体质量不变,物质的量减小,则混合气体的平均相对分子质量将增大,故答案为:增大.
点评 本题考查位置结构性质相互关系及应用,为高频考点,涉及平衡移动原理、原子晶体、元素周期律、化学用语等知识点,明确基本原理、位置结构、元素周期律内涵是解本题关键,注意Si3N4是原子晶体,存在空间立体网状结构,题目难度不大.

| A | B | C | |
| D |
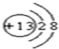
(1)C元素在元素周期表中的位置是第二周期第VIA 族.元素D的离子结构示意图为
(2)B、E两元素按原子数目比1:3和2:4构成分子X和Y,X的电子式为
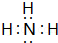 ,Y的结构式为
,Y的结构式为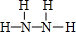
(3)工业上冶炼单质D的化学反应方程式2Al2O3(熔融)$\frac{\underline{\;\;\;电解\;\;\;}}{冰晶石}$4Al+3O2↑.
(4)超细DB粉末被应用于大规模集成电路领域.其制作原理为D2C3、B2、A在高温下反应生成两种化合物,这两种化合物均由两种元素组成,且原子个数比均为1:l;其反应的化学方程式为Al2O3+N2+3C $\frac{\underline{\;高温\;}}{\;}$ 2AlN+3CO.
| A. | 2CO(g)+O2(g)═2CO2(g)△H=-566.0 kJ/mol | |
| B. | C(s)+$\frac{1}{2}$O2(g)═CO(g)△H=-110.5 kJ/mol | |
| C. | CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H=-890.31 kJ/mol | |
| D. | 2C8H18(l)+25O2(g)═16CO2(g)+18H2O(l)△H=-11036 kJ/mol |
| A. | 除去乙烷中的少量乙烯:催化剂和加热条件下通入足量的H2 | |
| B. | 除去乙醇中少量的水:加新制生石灰,蒸馏 | |
| C. | 除去溴苯中少量苯:分液 | |
| D. | 除去硝基苯中的HNO3和H2SO4:加入足量NaOH溶液分液 |
| A. | ③④⑤⑧ | B. | ④⑤⑦ | C. | ④⑤ | D. | ③④⑤⑦⑧ |
| A. | 氧化性:F2>C12>Br2 | B. | 酸性:HClO4>H2SO4>H3PO4 | ||
| C. | 熔沸点:SiO2>NaCl>CO2 | D. | 热稳定性:SiH4>PH3>H2S |
| A. | 甲烷分子的比例模型: | B. | 甲基的电子式: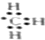 | ||
| C. | 乙烷的分子式:CH3CH3 | D. | 丙烷的结构式:CH3CH2CH3 |
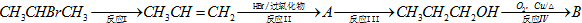 请回答下列问题:
请回答下列问题: