题目内容
1.6g某单质X能从盐酸中置换出0.3g H2,同时生成XCl2;另一种元素Y,它的最高价氧化物的化学式为YO3,在Y的氢化物中,Y的质量分数为94.1%.X和Y原子中质子数均等于中子数,Z元素的氢化物与它的最高价氧化物的水化物反应可生成一种盐,(1)X、Y两元素的相对原子质量:X40;Y32.
(2)写出Y的另一种常见氧化物与足量X的最高价氧化物对应水化物反应的化学方程式SO2+Ca(OH)2=CaSO3+H2O.
(3)Z元素的氢化物与它的最高价氧化物的水化物反应的化学方程式为NH3+HNO3=NH4NO3
(4)Z元素的氢化物的沸点比同族其它元素的氢化物的沸点高(填“高”或者“低”)原因是氨气分子之间形成了氢键.
分析 6g某单质X能从盐酸中置换出0.3g H2,同时生成XCl2,X为金属,设X的相对原子质量为a,根据电子转移守恒,则$\frac{6}{a}$×2=$\frac{0.3}{2}$×2,解得a=40,质子数等于中子数,故X质子数为20,则X为Ca;Y的最高价氧化物的化学式为YO3,则Y的氢化物为H2Y,设Y的相对原子质量为b,则$\frac{b}{b+2}$=94.1%,解得b=32,质子数等于中子数,故Y质子数为16,则Y为S元素;Z元素的氢化物与它的最高价氧化物的水化物反应可生成一种盐,则Z为N元素.
解答 解:6g某单质X能从盐酸中置换出0.3g H2,同时生成XCl2,X为金属,设X的相对原子质量为a,根据电子转移守恒,则$\frac{6}{a}$×2=$\frac{0.3}{2}$×2,解得a=40,质子数等于中子数,故X质子数为20,则X为Ca;Y的最高价氧化物的化学式为YO3,则Y的氢化物为H2Y,设Y的相对原子质量为b,则$\frac{b}{b+2}$=94.1%,解得b=32,质子数等于中子数,故Y质子数为16,则Y为S元素;Z元素的氢化物与它的最高价氧化物的水化物反应可生成一种盐,则Z为N元素.
(1)由上述分析可知,X相对原子质量为40,Y元素的相对原子质量为32,
故答案为:40;32;
(2)Y的另一种常见氧化物与足量X的最高价氧化物对应水化物反应的化学方程式:SO2+Ca(OH)2=CaSO3+H2O,
故答案为:SO2+Ca(OH)2=CaSO3+H2O;
(3)Z元素的氢化物与它的最高价氧化物的水化物反应的化学方程式为:NH3+HNO3=NH4NO3,
故答案为:NH3+HNO3=NH4NO3;
(4)氨气分子之间形成了氢键,沸点比同族其它元素的氢化物的沸点高,
故答案为:高;氨气分子之间形成了氢键.
点评 本题考查元素推断、元素化合物性质、常用化学用语,关键是计算推断元素,注意氢键对物质性质的影响.

 新课标阶梯阅读训练系列答案
新课标阶梯阅读训练系列答案Ⅰ.用AXnEm表示只含一个中心原子的分子组成,A为中心原子,X为与中心原子相结合的原子,E为中心原子最外层未参与成键的电子对(称为孤电子对),(n+m)称为价层电子对数.分子中的价层电子对总是互相排斥,均匀地分布在中心原子周围的空间;
Ⅱ.分子的空间构型是指分子中的原子在空间的排布,不包括中心原子未成键的孤电子对;
Ⅲ.分子中价层电子对之间的斥力主要顺序为:
ⅰ.孤电子对之间的斥力>孤电子对与共用电子对之间的斥力>共用电子对之间的斥力;ⅱ.双键与双键之间的斥力>双键与单键之间的斥力>单键与单键之间的斥力;ⅲ.X原子得电子能力越弱,A-X形成的共用电子对之间的斥力越强;ⅳ.其他.请仔细阅读上述材料,回答下列问题:
(1)根据要点Ⅰ可以画出AXnEm的VSEPR理想模型,请填写下表:
| n+m | 2 | |
| VSEPR理想模型 | 正四面体形 | |
| 价层电子对 之间的理想键角 | 109°28′ |
(3)用价层电子对互斥理论(VSEPR)判断下列分子或离子的空间构型:
| 分子 | |||
| 或离子 | SnCl2 | CCl4 | ClO${\;}_{4}^{-}$ |
| 立体构型 |
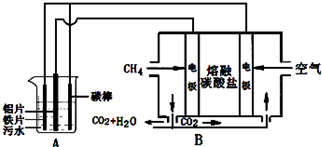
| A. | 装置A中碳棒为阴极 | |
| B. | 污水中加入适量的硫酸钠,可增强溶液的导电性 | |
| C. | 装置B中通入空气的电极反应是O2+2H2O+4e-=4OH- | |
| D. | 标准状况下,若A装置中产生44.8 L气体,则理论上B装置中要消耗CH411.2L |
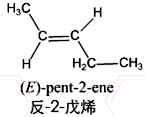
| A. | 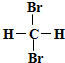 和 和 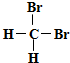 是同一物质 是同一物质 | |
| B. | 1866年凯库勒提出了苯的单、双键交替的正六边形平面结构,解释了苯的部分性质,但它不能解释的事实是邻二溴苯只有一种. | |
| C. | 某有机物化学式为C3H6O2,其核磁共振氢谱有三个峰,其强度比为3:2:1,则该有机物的结构简式一定是CH3CH2COOH | |
| D. | 在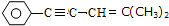 分子中一定共面的碳原子最多为9个,可能共面的碳原子最多为12个 分子中一定共面的碳原子最多为9个,可能共面的碳原子最多为12个 |
| A. | 用惰性电极电解MgCl2 溶液:2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| B. | 1molN2与3molH2在某密闭容器中反应放出73kJ热量,则反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-73kJ/mol | |
| C. | 将AlCl3溶液与Na2S混合产生沉淀:2Al3++3S2-═Al2S3↓ | |
| D. | 2NaOH(aq)+H2SO4(aq)=Na2SO4(aq)+2H2O(l)△H=-akJ•mol-1,则中和热为0.5akJ•mol-1 |
| A. | SO2可用于杀菌、消毒,但不可用来加工食品 | |
| B. | 液氨汽化时要吸收大量热,因此氨常用作制冷剂 | |
| C. | PM2.5是指大气中直径小于或等于2.5微米的细小可吸入颗粒物,其分散在空气中能形成气溶胶 | |
| D. | 铝箔在酒精灯上加热铝熔化但不滴落,说明氧化铝的熔点高于铝的熔点 |
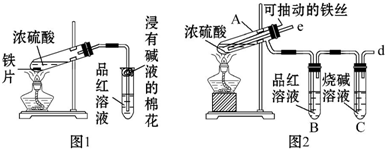
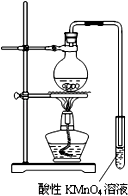 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物. .
. ;其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为:
;其中有一种分子中,所有碳原子都在同一平面内,它发生加聚反应的化学方程式为: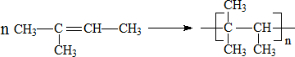 .
. .
.