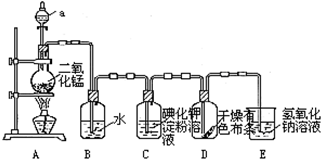
题目内容
12.电浮选凝聚法是工业上采用的一种污水处理方法,某研究小组用电浮选凝聚法处理污水,设计装置如图所示,下列说法正确的是( )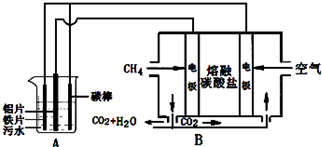
| A. | 装置A中碳棒为阴极 | |
| B. | 污水中加入适量的硫酸钠,可增强溶液的导电性 | |
| C. | 装置B中通入空气的电极反应是O2+2H2O+4e-=4OH- | |
| D. | 标准状况下,若A装置中产生44.8 L气体,则理论上B装置中要消耗CH411.2L |
分析 B能自发的进行氧化还原反应,为原电池,通入甲烷的电极为负极,发生氧化反应,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,通入空气的一极为正极,发生还原反应,正极反应为O2+2CO2+4e-=2CO32-;
A有外接电源,属于电解池,电解池中Fe和碳棒为阳极,发生Fe-2e-=Fe2+,Al为阴极,阴极的电极反应为:2H++2e-=H2↑,二价铁离子具有还原性,能被氧气氧化到正三价,4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,据此分析解答.
解答 解:B能自发的进行氧化还原反应,为原电池,通入甲烷的电极为负极,发生氧化反应,负极电极反应是CH4+4CO32--8e-=5CO2+2H2O,通入空气的一极为正极,发生还原反应,正极反应为O2+2CO2+4e-=2CO32-;
A有外接电源,属于电解池,电解池中Fe和碳棒为阳极,发生Fe-2e-=Fe2+,Al为阴极,阴极的电极反应为:2H++2e-=H2↑,二价铁离子具有还原性,能被氧气氧化到正三价,4Fe2++10H2O+O2=4Fe(OH)3↓+8H+,
A.通过以上分析知,A中碳棒连接原电池正极,为电解池阳极,故A错误;
B.离子浓度越大,溶液导电性越强,纯水中离子浓度很小,加入硫酸钠后溶液中离子浓度大,且不参加反应,所以能起到增强导电性作用,故B正确;
C.B中电解质为熔融碳酸盐,所以正极反应式为O2+2CO2+4e-=2CO32-,故C错误;
D.A装置中阴极的电极反应为:2H++2e-=H2↑,阴极产生了44.8L(标准状况)即2mol的气体产生,但是碳棒为阳极,阳极上还可以生成氧气,所以参加反应的甲烷大于11.2L,故D错误;
故选B.
点评 本题考查原电池和电解池原理,为高频考点,侧重考查学生分析计算能力,明确原电池和电解池区别、各个电极上发生的反应、转移电子守恒是解本题关键,易错选项是CD,注意A中碳棒上也可能生成气体,难点是电极反应式的书写,要结合电解质特点书写,题目难度中等.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. | 除去乙烷中乙烯的方法是将气体通过足量的酸性KMnO4溶液 | |
| B. | 向2mL2%的硝酸银溶液中滴加2%的稀氨水至沉淀恰好溶解即得到银氨溶液 | |
| C. | 分别将去膜的镁条和铝片投入等浓度的稀盐酸中,通过观察实验现象判断其金属性强弱 | |
| D. | 在淀粉溶液中加入少量稀硫酸,加热4~5min,冷却后加入新制的氢氧化铜浊液并加热至沸腾,根据现象判断淀粉是否水解 |
| A. | 常温时与锌反应生成大量氢气 | |
| B. | 置于敞口容器中,经过一段时间后质量将减少 | |
| C. | 常温时与铁、铝不反应 | |
| D. | 稀释时将浓硫酸沿器壁慢慢加到水中并不断搅拌 |
| A. | SO3 | B. | Mn2O7 | C. | CO | D. | P2O5 |
 人们研究金星大气成分,发现金星大气中有一种称之为羰基硫(COS)的分子,已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断有关说法正确的是( )
人们研究金星大气成分,发现金星大气中有一种称之为羰基硫(COS)的分子,已知羰基硫分子中所有原子的最外层都满足8电子结构,结合已学知识,判断有关说法正确的是( )| A. | 羰基硫属于非极性分子 | |
| B. | 羰基硫的电子式为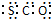 | |
| C. | 羰基硫的沸点比CO2低 | |
| D. | 羰基硫分子中三个原子处于同一直线上 |
| A. | 在溴水中存在如下平衡:Br2+H2O=HBr+HBrO,当加入NaOH溶液后颜色变浅 | |
| B. | 对2HI?H2+I2(气)平衡体系增加压强使颜色变深 | |
| C. | 反应CO+NO2?CO2+NO+Q升高温度使平衡向逆方向移动 | |
| D. | 合成氨反应:N2+3H2?2NH3+Q,为使氨的产率提高,理论上应采取低温高压的措施 |