题目内容
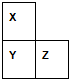 X、Y、Z、W、R是短周期元素,X、Y、Z在周期表中的位置如图所示,其中Z的族序数与周期序数之差为4,W最高价氧化物水化物的阴、阳离子电子数相等,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应.
X、Y、Z、W、R是短周期元素,X、Y、Z在周期表中的位置如图所示,其中Z的族序数与周期序数之差为4,W最高价氧化物水化物的阴、阳离子电子数相等,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应.请填写下列空白:
(1)Z原子结构示意图为
(2)W2Y水溶液中,阴离子浓度由大到小的顺序是
(3)R单质与W最高价氧化物水化物的溶液反应的化学方程式是:
(4)Y单质溶解在热的KOH弄人也中,反应生成两种阴离子YO32-和
(5)已知298K时,Fe(s)+
| 1 |
| 2 |
2R(s)+
| 3 |
| 2 |
写出R单质和FeO反应的热化学方程式:
考点:位置结构性质的相互关系应用
专题:
分析:X、Y、Z、W、R是短周期元素,Z的族序数与周期序数之差为4,则Z为为第二周期第ⅥA族或在第三周期第ⅤⅡA族,根据Z在周期中与X、Y的位置关系可知,Z为氯元素,所以Y为硫元素,X为氧元素,W最高价氧化物水化物的阴、阳离子电子数相等,则说明W最高价氧化物水化物是离子化合物,是碱,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应,则说明R为铝元素,W为钠元素,据此答题.
解答:
解:X、Y、Z、W、R是短周期元素,Z的族序数与周期序数之差为4,则Z为为第二周期第ⅥA族或在第三周期第ⅤⅡA族,根据Z在周期中与X、Y的位置关系可知,Z为氯元素,所以Y为硫元素,X为氧元素,W最高价氧化物水化物的阴、阳离子电子数相等,则说明W最高价氧化物水化物是离子化合物,是碱,R与W同周期,R最高价氧化物的水化物与W、Y最高价氧化物的水化物均能反应,则说明R为铝元素,W为钠元素,
(1)Z为氯元素,原子结构示意图为 ,故答案为:
,故答案为: ;
;
(2)Na2S水溶液中,由于硫离子水解,会生成硫氢根离子和氢氧根离子,但水解程度不是很大,水电离也产生氢氧根离子,所以溶液中阴离子浓度由大到小的顺序是c(S2-)>c(OH-)>c(HS-),W2X2为过氧化钠,常用作供氧剂等,
故答案为:c(S2-)>c(OH-)>c(HS-);作供氧剂;
(3)铝与氢氧化钠的溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)硫单质溶解在热的KOH溶液中,硫发生自身氧化还原反应,反应生成两种阴离子SO32-和S2-,
故答案为:S2-;
(5)已知298K时,①Fe(s)+
O2(g)=FeO(s)△H=-272.0kJ?mol-1;②2Al(s)+
O2(g)=Al2O3(s)△H=-1675.7 kJ?mol-1,根据盖斯定律,将②-①×3得Al单质和FeO反应的热化学方程式为2Al(s)+FeO(s)=Fe(s)+Al2O3(s)△H=-1675.7kJ?mol-1-(-272.0)×3kJ?mol-1=-859.7kJ?mol-1,
故答案为:2Al(s)+FeO(s)=Fe(s)+Al2O3(s)△H=-859.7kJ?mol-1.
(1)Z为氯元素,原子结构示意图为
 ,故答案为:
,故答案为: ;
; (2)Na2S水溶液中,由于硫离子水解,会生成硫氢根离子和氢氧根离子,但水解程度不是很大,水电离也产生氢氧根离子,所以溶液中阴离子浓度由大到小的顺序是c(S2-)>c(OH-)>c(HS-),W2X2为过氧化钠,常用作供氧剂等,
故答案为:c(S2-)>c(OH-)>c(HS-);作供氧剂;
(3)铝与氢氧化钠的溶液反应的化学方程式是2Al+2NaOH+2H2O=2NaAlO2+3H2↑,
故答案为:2Al+2NaOH+2H2O=2NaAlO2+3H2↑;
(4)硫单质溶解在热的KOH溶液中,硫发生自身氧化还原反应,反应生成两种阴离子SO32-和S2-,
故答案为:S2-;
(5)已知298K时,①Fe(s)+
| 1 |
| 2 |
| 3 |
| 2 |
故答案为:2Al(s)+FeO(s)=Fe(s)+Al2O3(s)△H=-859.7kJ?mol-1.
点评:本题主要考查了原子结构示意图、离子浓度大小比较、氧化还原反应、热化学方程式等知识,中等难度,元素推断是解题关键,答题时注意基本知识的灵活运用.

练习册系列答案
 互动英语系列答案
互动英语系列答案
相关题目
已知:2M(g)?N(g);△H<0.现将M和N的混和气体通入体积为1L的恒温密闭容器中,反应体系中物质浓度随时间变化关系如图所示.下列说法正确的是( )


| A、a、b、c、d四个点中处于平衡状态的点是a、b d |
| B、反应进行至25min时,曲线发生变化的原因是加入了 0.4molN |
| C、若调节温度使35min时体系内N的百分含量与15min时相等,应升高温度 |
| D、若40min后出现如图所示变化,则可能是加入了某种催化剂 |
下列说法不正确的是( )
| A、在室内放置一些特别的绿色植物,可用于室内空气的净化 |
| B、合金的熔点一般高于各组成成分金属的熔点 |
| C、氢氧化钠溶液用盖橡胶塞的试剂瓶盛装 |
| D、工业上用盐酸刻蚀玻璃 |
已知I-、Fe2+、SO2、Cl-和H2O2均有还原性、它们在酸性溶液中还原性强弱顺序为Cl-<H2O2<Fe2+<I-<SO2,则下列反应不能发生的是( )
| A、2Fe2++I2=2Fe3++2I- |
| B、2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
| C、SO2+I2+2H2O=H2SO4+2HI |
| D、H2O2+SO2=H2SO4 |
下列模型分别是HCN、S8、SF6、B12结构单元,下列说法错误的是( )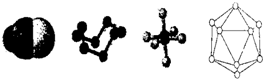

| A、已知单质硼的结构单元是由20个正三角形构成的正二十面体,则这个结构单元中含有30个B-B键、12个硼原子 |
| B、SF6为正八面体的非极性分子 |
| C、1 molHCN分子中有2 molσ键和2molπ键 |
| D、32gS8分子中含有0.125 molσ键 |
有两种体积相同的某植物的营养液,其配方如下表所示:对于两种营养液的成分,下列说法中,正确的是( )
| KCl | K2SO4 | ZnSO4 | ZnCl2 | |
| 1 | 0.3mol | 0.2mol | 0.1mol | - |
| 2 | 0.1mol | 0.3mol | - | 0.1mol |
| A、只有n(K+)相同 |
| B、只有n(Cl-)相同 |
| C、各离子的物质的量均不同 |
| D、各离子的物质的量完全相同 |
下列解释实验现象的反应方程式不正确的是( )
| A、SO2通入到滴加酚酞的NaOH溶液中,红色变浅:SO2+2NaOH=Na2SO3+H2O |
| B、用Na2S处理含Hg2+废水:Hg2++S2-═HgS↓ |
| C、等浓度的NH4Al(SO4)2溶液与Ba(OH)2溶液以1:2体积比混合出现白色沉淀:NH4++Al3++2SO42-+2Ba2++4OH-=2BaSO4↓+Al(OH)3↓+NH3?H2O |
| D、用Na2CO3溶液处理水垢中的CaSO4:Ca2++CO32-═CaCO3↓ |



