题目内容
19.钠放入盛有空气的密闭容器中生成Na2O和Na2O2,这是下列哪些因素决定的( )| A. | 反应温度 | B. | 空气的量 | C. | 钠粒的大小 | D. | 钠的状态 |
分析 钠在空气中放置生成白色的氧化钠,而在空气中加热或者点燃则生成淡黄色固体过氧化钠.
解答 解:钠在空气中放置生成白色的氧化钠,而在空气中加热或者点燃则生成淡黄色固体过氧化钠,从反应条件可知,反应温度对产物有重大影响,和空气的量、钠锂大小及其状态无关,
故选A.
点评 本题考查了钠的性质,明确钠与空气中反应生成氧化钠和过氧化钠的反应条件是解题关键,题目难度不大.

练习册系列答案
 冲刺100分1号卷系列答案
冲刺100分1号卷系列答案
相关题目
9.下列化学用语正确的是( )
| A. | 中子数为18的硫原子:1816S | B. | HClO的结构式为:H-O-Cl | ||
| C. | H2O2的电子式: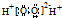 | D. | 聚乙烯的结构简式: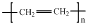 |
10.新型 NaBH4/H2O2燃料电池(DBFC)的结构如图,(已知硼氢化钠中氢为-1价),有关该电池的说法正确的是( )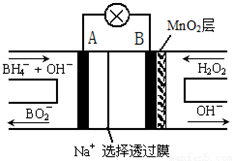

| A. | 放电过程中,正极附近溶液中的H+浓度减小 | |
| B. | 电池正极区的电极反应为:BH${\;}_{4}^{-}$+8OH--8e-=BO$_2^-$+6H2O | |
| C. | 放电过程中,Na+从正极区向负极区迁移 | |
| D. | 在电池反应中,每消耗1L 6 mol/LH2O2溶液,理论上流过电路中的电子为6NA个 |
14.下列物质中,长期露置在空气中,不会变质的是( )
| A. | AgI | B. | 漂白粉 | C. | 食盐 | D. | 次氯酸钙溶液 |
4.下列各组物质的反应,有机产物中没有同分异构体的是( )
| A. | CH3CH═CH2与HBr | B. |  -CH3与混酸(浓HNO3和浓H2SO4,30℃) -CH3与混酸(浓HNO3和浓H2SO4,30℃) | ||
| C. | CH3CH═CHCH3与HBr | D. | 光照条件下CH3CH3与Cl2 |
11.某有机物分子式为C5H10Cl2,其主链有4个碳原子的同分异构体共有多少种( )
| A. | 8 | B. | 9 | C. | 10 | D. | 11 |
8.己烷雌酚的一种合成路线如图:
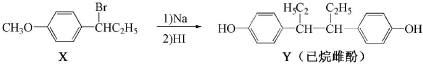
下列叙述错误的是( )

下列叙述错误的是( )
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y能使酸性高锰酸钾溶液褪色 |
9.X、Y、Z、W是元素周期表前四周期中原子序数依次增大的常见元素,其相关信息如表:
(1)Y位于元素周期表第二周期第VA族;Y和Z的氢化物稳定性顺序为:H2O>NH3(写化学式).
(2)X、Y、Z的第一电离能由大到小的顺序为N>O>C;W的基态原子核外电子排布式是1s22s22p63s23p63d64s2(或[Ar]3d64s2)
(3)向W单质与盐酸反应后的溶液中通入过量Y的气态氢化物,能观察到的现象是先出现白色沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色,发生反应的化学方程式是FeCl2+2NH3.H2O=Fe(OH)2↓+2NH4Cl、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)已知Y的氢化物在催化加热的条件下,可以与Z2发生氧化还原反应,并且在室温下每转移10mol电子放热akJ,该反应的热化学方程式是4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-2akJ.mol-1.
| 元素 | 相关信息 |
| X | X的一种单质是自然界硬度最大的晶体 |
| Y | Y的基态原子最外层电子排布式为nsnnpn+1 |
| Z | Z的基态原子L层电子数是K层电子数的3倍 |
| W | W的一种核素的质量数为58,中子数为32 |
(2)X、Y、Z的第一电离能由大到小的顺序为N>O>C;W的基态原子核外电子排布式是1s22s22p63s23p63d64s2(或[Ar]3d64s2)
(3)向W单质与盐酸反应后的溶液中通入过量Y的气态氢化物,能观察到的现象是先出现白色沉淀,白色沉淀迅速变成灰绿色,最后变成红褐色,发生反应的化学方程式是FeCl2+2NH3.H2O=Fe(OH)2↓+2NH4Cl、4Fe(OH)2+O2+2H2O=4Fe(OH)3.
(4)已知Y的氢化物在催化加热的条件下,可以与Z2发生氧化还原反应,并且在室温下每转移10mol电子放热akJ,该反应的热化学方程式是4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H=-2akJ.mol-1.
 ;
;