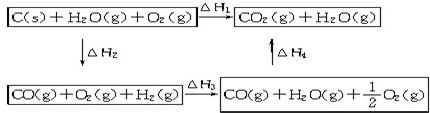
题目内容
8.己烷雌酚的一种合成路线如图: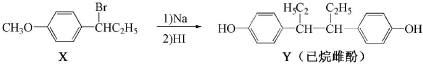
下列叙述错误的是( )
| A. | 在NaOH水溶液中加热,化合物X可发生消去反应 | |
| B. | 在一定条件,化合物Y可与HCHO发生缩聚反应 | |
| C. | 用FeCl3溶液可鉴别化合物X和Y | |
| D. | 化合物Y能使酸性高锰酸钾溶液褪色 |
分析 A.X中含-Br,在NaOH溶液中加热发生水解反应;
B.Y中含酚-OH,且酚-OH的邻位均有H;
C.X中不含酚-OH,Y中含酚-OH;
D.Y中含酚-OH,能被氧化.
解答 解:A.X中含-Br,在NaOH溶液中加热发生水解反应生成醇,而在NaOH、醇溶液中加热发生消去反应,故A错误;
B.Y中含酚-OH,且酚-OH的邻位均有H,则化合物Y可与HCHO发生缩聚反应,故B正确;
C.X中不含酚-OH,Y中含酚-OH,Y遇氯化铁显紫色,则用FeCl3溶液可鉴别化合物X和Y,故C正确;
D.Y中含酚-OH,能使酸性高锰酸钾溶液褪色,故D正确;
故选A.
点评 本题以有机物的合成考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重分析与应用能力的考查,注意酚、卤代烃的性质及应用,题目难度不大.

练习册系列答案
相关题目
18.铝热反应是铝的一个重要性质.某校化学兴趣小组同学,取磁性氧化铁在如图1实验装置进行铝热反应,冷却后得到“铁块”混合物.
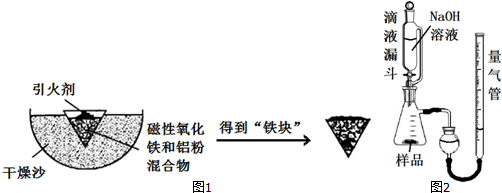
(1)取反应后的“铁块”研碎取样称量,加入如图2装置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温.
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会(填“偏大”或“偏小”).
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图3所示.

几种氢氧化物开始沉淀和完全沉淀的pH如表所示.
①试剂A应选择C,试剂B应选择D.(填序号)
A.稀盐酸 B.氧化铁C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.

(1)取反应后的“铁块”研碎取样称量,加入如图2装置滴入足量NaOH溶液充分反应,测量生成气体体积.试回答下列问题:
①该实验的实验目的是:测量样品中铝的百分含量(填物质名称).
②量气管的量具部分是一个中学实验常见量具改装而成,该仪器的名称为.
③量气管在读数时调节左右管液面相平之前的步骤是恢复到室温.
④装置中使用带平衡管的滴液漏斗代替普通分液漏斗,除了可以平衡压强让液体顺利滴入锥形瓶之外还可以起到降低实验误差的作用.如果装置使用分液漏斗,测量出的该物质百分含量将会(填“偏大”或“偏小”).
(2)另称取“铁块”样品溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色.为测定该实验所得“铁块”的成分,实验流程如图3所示.

几种氢氧化物开始沉淀和完全沉淀的pH如表所示.
| Fe2+ | Fe3+ | Al3+ | Mg2+ | |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
A.稀盐酸 B.氧化铁C.H2O2溶液 D.氨水 E.MgCO3固体
②灼烧完全的标志是前后两次灼烧质量相差不大于0.1g.
③若最终红色粉未M的质量为12.0g,则该“铁块”中铁的百分含量是84%.
19.钠放入盛有空气的密闭容器中生成Na2O和Na2O2,这是下列哪些因素决定的( )
| A. | 反应温度 | B. | 空气的量 | C. | 钠粒的大小 | D. | 钠的状态 |
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 用CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数为2×6.02×1023 | |
| D. | 标准状况下,80g SO3中含3NA个氧原子,体积约为22.4L |
13.如图装置能达到实验目的是( )
| A. |  检验产物中含有乙烯 | B. |  中和热的测定 | ||
| C. |  验证减压蒸馏原理 | D. |  验证碳酸的酸性强于苯酚 |
20.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 1mol乙醚中含有的C-O键的数目为2NA | |
| B. | 标准状况下,44.8CHCl3中含有分子的数目为2NA | |
| C. | 1 mol-CH3中所含的电子总数为10 NA | |
| D. | 向FeI2溶液中通入适量Cl2,当有2 mol Fe2+被氧化时,消耗Cl2的分子数为NA |
17.某元素基态原子失去3个电子后,3d轨道半充满,其原子序数为( )
| A. | 24 | B. | 25 | C. | 26 | D. | 27 |
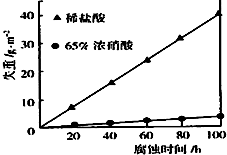 按要求回答下列问题:
按要求回答下列问题: