题目内容
4.下列各组物质的反应,有机产物中没有同分异构体的是( )| A. | CH3CH═CH2与HBr | B. | 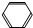 -CH3与混酸(浓HNO3和浓H2SO4,30℃) -CH3与混酸(浓HNO3和浓H2SO4,30℃) | ||
| C. | CH3CH═CHCH3与HBr | D. | 光照条件下CH3CH3与Cl2 |
分析 A、CH3CH═CH2不是对称结构;
B、依甲苯在苯环上存在邻、间、对位置的氢可以被取代分析;
C、CH3CH═CH2是对称结构;
D、乙烷与氯气发生取代反应能够生成一元取代、二元取代…直到完全取代.
解答 解:A.CH3CH═CH2不是对称结构,溴原子可以加成在双键相连的碳原子上,有2种结构,存在同分异构体,故A错误;
B.甲苯在一定条件下发生硝化生成一硝基甲苯的反应,可生成邻-硝基甲苯、间-硝基甲苯和对-硝基甲苯3种物质,存在同分异构体,故B错误;
C.CH3CH═CH2是对称结构,溴原子可以加成在双键相连的碳原子上,但只有1种结构,存在同分异构体,故C正确;
D.乙烷与氯气发生取代反应,分别生成一氯乙烷、二氯乙烷、三氯乙烷、四氯乙烷、五氯乙烷、六氯乙烷和氯化氢,其中二氯乙烷、三氯乙烷、四氯乙烷存在同分异构体,故D错误;
故选C.
点评 本题考查了反应生成物质的不同方式,同分异构体的概念,主要从官能团的化学性质考查反应的实质,关键是理解消去反应、取代反应、烯烃加成反应的含义和产物判断.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
14.煤气化的一种方法是在气化炉中给煤炭加氢,发生的主要反应为:C(s)+2H2(g)?CH4(g).在VL的容器中投入a mol碳(足量),同时通入2a molH2,控制条件使其发生上述反应,实验测得碳的平衡转化率随压力及温度的变化关系如图所示.下列说法正确的是( )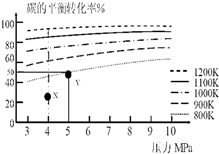

| A. | 上述正反应为吸热反应 | |
| B. | 在5MPa、800K时,该反应的平衡常数为$\frac{{V}^{2}}{{a}^{2}}$L2•mol-2 | |
| C. | 在4MPa、1200K时,图中X点υ(H2)正>υ(H2)逆 | |
| D. | 工业上维持6MPa 1000K而不采用10MPa1000K,主要是因为前者碳的转化率高 |
19.钠放入盛有空气的密闭容器中生成Na2O和Na2O2,这是下列哪些因素决定的( )
| A. | 反应温度 | B. | 空气的量 | C. | 钠粒的大小 | D. | 钠的状态 |
9.下列各组物质中互为同分异构体的是( )
| A. | 1H与2H | B. | O2与O3 | C. | 乙烷与甲烷 | D. | 正丁烷与异丁烷 |
16.用NA表示阿伏加德罗常数的值.下列叙述正确的是( )
| A. | 常温常压下的33.6L氯气与27g铝充分反应,转移电子数为3NA | |
| B. | 用CO2和O2组成的混合物中共有NA个分子,其中的氧原子数为2NA | |
| C. | Na2O2与H2O反应生成1.12L O2(标准状况),反应中转移的电子数为2×6.02×1023 | |
| D. | 标准状况下,80g SO3中含3NA个氧原子,体积约为22.4L |
13.如图装置能达到实验目的是( )
| A. |  检验产物中含有乙烯 | B. |  中和热的测定 | ||
| C. |  验证减压蒸馏原理 | D. |  验证碳酸的酸性强于苯酚 |
14.X、Y、Z、M、G五种主族元素分属三个短周期,且原子序数依次增大.X、Z同主族,可形成离子化合物 ZX;Y、M同主族,可形成 MY2、MY3两种分子.
请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式);
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、O3
(写出其中两种物质的化学式);
(4)ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑;
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一.元素 E位于第四周期,与元素 Y同主族.在下表中列出对 H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中 E用元素符号表示)
(6)由碳元素(C)、Y和 M三种元素组成的化合物 CYM中,所有原子的最外层满足 8电子结构.写出该化合物的电子式(电子式中 Y、M用元素符号表示)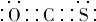 .
.
请回答下列问题:
(1)Y在元素周期表中的位置为第二周期第ⅥA族;
(2)上述元素的最高价氧化物对应的水化物酸性最强的是HClO4(写化学式),非金属气态氢化物还原性最强的是H2S(写化学式);
(3)Y、G的单质或两元素之间形成的化合物可作水消毒剂的有Cl2、O3
(写出其中两种物质的化学式);
(4)ZX与水反应放出气体的化学方程式为NaH+H2O=NaOH+H2↑;
(5)探究同主族元素性质的一些共同规律,是学习化学的重要方法之一.元素 E位于第四周期,与元素 Y同主族.在下表中列出对 H2EO3各种不同化学性质的推测,举例并写出相应的化学方程式(化学方程式中 E用元素符号表示)
| 编号 | 性质推测 | 化学方程式 |
| 示例 | 氧化性 | H2EO3+4HI═Z↓+2I2+3H2O |
| 1 | ||
| 2 |
 .
. 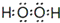 ;
; 氮元素可形成卤化物、叠氮化物及配合物等
氮元素可形成卤化物、叠氮化物及配合物等