题目内容
1.下列说法正确的是( )| A. | 碘单质能升华是由于碘单质分子间的键能较小 | |
| B. | 键能越大,则含该键的分子受热越易分解为原子 | |
| C. | 燃料燃烧过程中,反应物的总能量总是高于生成物的总能量 | |
| D. | H-Cl键的键能为431kJ•mol-1,H-I键的键能为299kJ•mol-1,这说明HCl分子比HI分子稳定 |
分析 A.碘升华破坏分子间作用力;
B.键能越大,键越稳定;
C.放热反应中反应物的总能量大于生成物的总能量;
D.键能越大,共价键越稳定.
解答 解:A.碘升华破坏分子间作用力,碘单质能升华是由于碘单质分子间作用力较小,故A错误;
B.键能越大,键越稳定,该分子受热越不易分解为原子,故B错误;
C.燃料燃烧为放热反应,放热反应中反应物的总能量大于生成物的总能量,故C正确;
D.键能越大,共价键越稳定,H-Cl键的键能为431kJ•mol-1,H-I键的键能为299kJ•mol-1,这说明HCl分子比HI分子稳定,故D正确.
故选CD.
点评 本题考查了化学键与键能、分子稳定性,题目难度不大,注意把握键能与分子稳定性之间的关系,侧重于考查学生的分析能力.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
9.X、Y、Z、M、W为五种短周期元素.X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子,Y与M形成的气态化合物在标准状况下的密度为0.76g•L-1,W在短周期主族元素中原子半径最大.下列说法不正确的是( )
| A. | 原子半径:W>Y>M | |
| B. | 由X、Y、Z、M 四种元素形成的化合物一定既有离子键,又有共价键 | |
| C. | W 和Z 形成的常见化合物中阴、阳离子物质的量之比均为1:2 | |
| D. | 由X 元素形成的单质晶体不一定是原子晶体 |
6.试管内壁附着的以下物质用KOH溶液(必要时可加热)难以洗去的是( )
| A. | 硫 | B. | 油渍 | C. | 石炭酸 | D. | 酚醛树脂 |
13.用下列装置进行的相应实验能达到实验目的是( )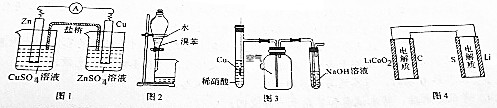

| A. | 图1装置设计铜锌双液原电池 | |
| B. | 图2装置用于分离水和溴苯的混合物 | |
| C. | 图3装置用于制备并收集NO气体 | |
| D. | 图4装置锂硫电池(2Li+S$?_{充电}^{放电}$Li2S)给锂离子电池充电(LixC+Li1-xCo2$?_{充电}^{放电}$C+LiCoO2) |
13.关于下列各装置图的叙述中,正确的是( )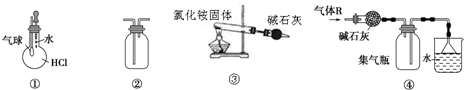

| A. | 装置①可验证HCl气体在水中的溶解性 | |
| B. | 装置②可用排空气法收集H2、NH3、Cl2、HCl、CO2等气体 | |
| C. | 装置③实验室用氯化铵制少量氨气 | |
| D. | 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
14.关于下列图象的说法正确的是( )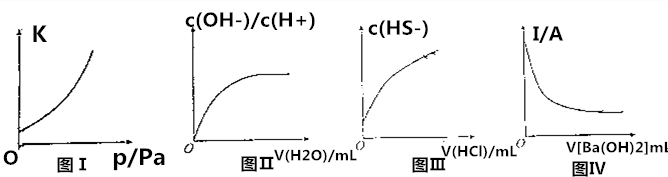

| A. | 图Ⅰ:其他条件不变,反应2NO2(g)?N2O4(g)的平衡常数与压强的关系 | |
| B. | 图Ⅱ:25℃时,稀释0.1mol•L-1CH3COOH溶液,$\frac{c(O{H}^{-})}{c({H}^{+})}$与加水的体积的关系 | |
| C. | 图Ⅲ:25℃时,向0.1mol•L-1Na2S溶液中滴加稀盐酸至足量,c(HS-)与盐酸体积的关系 | |
| D. | 图Ⅳ:一定温度下,稀硫酸的导电能力与加入的Ba(OH)2溶液体积的关系 |


 的名称对氟苯甲醛.
的名称对氟苯甲醛.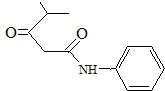 .
.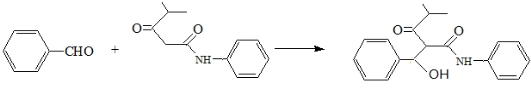 .
.
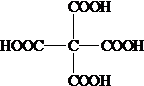 .
.