题目内容
11.下列物质中:互为同素异形体的有③⑤ (填序号,下同),属于同位素的有②⑥,属于同一种物质的有①④.①液氯和氯气 ②16O、17O和18O ③金刚石与“足球烯”C60 ④白磷和P4 ⑤O2与O3 ⑥D与T.
分析 具有相同质子数,不同中子数或同一元素的不同核素互为同位素;
由同种元素形成的不同种单质互为同素异形体;
分子式相同、结构也相同的物质为同一种物质,据此分析.
解答 解:①液氯是液态的氯气,故和氯气是同一种物质;
②16O、17O和18O是同一种元素的不同种原子,故互为同位素;
③金刚石与“足球烯”C60 是同种元素形成的不同种单质,故互为同素异形体;
④白磷即P4,故是同一种物质;
⑤O2与O3 是同种元素形成的不同种单质,故互为同素异形体;
⑥D与T是同一种元素的不同种原子,故互为同位素;
故答案为:③⑤;②⑥;①④.
点评 本题考查同位素、同素异形体、同一种物质的概念,难度不大.对于元素、核素、同位素、同素异形体、同分异构体、同系物、同种物质等概念的区别是考试的热点问题.

练习册系列答案
相关题目
1.如表是元素周期表的一部分,针对表中的①~⑨种元素,填写下列空白:
(1)在这些元素中,化学性质最不活泼的是:Ar(填具体元素符号,下同).
(2)NH3电子式是: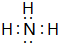 ;
;
(3)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>S.(用元素符号表示)
(4)①、⑥、⑦的最高价氧化物对应水化物的酸性最强的是HClO4>H2SO4>H2CO3.(用化学式表示)
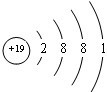
(5)写出 ⑥的原子结构示意图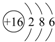 ;
;
(6)③氢化物的沸点大于(填“大于”、“小于”)⑥的氢化物的沸点.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ |
(2)NH3电子式是:
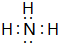 ;
;(3)④、⑤、⑥的原子半径由大到小的顺序为Na>Al>S.(用元素符号表示)
(4)①、⑥、⑦的最高价氧化物对应水化物的酸性最强的是HClO4>H2SO4>H2CO3.(用化学式表示)
(5)写出 ⑥的原子结构示意图
 ;
;(6)③氢化物的沸点大于(填“大于”、“小于”)⑥的氢化物的沸点.
6.下列反应中,既属于氧化还原反应,又是放热热反应的是( )
| A. | 铝片与稀盐酸的反应 | B. | Ba(OH)2•8H2O与NH4Cl的反应 | ||
| C. | 灼热的碳与二氧化碳的反应 | D. | 盐酸在烧碱溶液反应 |
3.含有元素硒(Se)的保健品已开始进入市场.已知它与氧同族,与钾同周期.则下列关于硒的叙述中,正确的是( )
| A. | 非金属性比硫强 | B. | 气态氢化物的化学式为H2Se | ||
| C. | 酸性:H2SeO4>H2SO4 | D. | 最高价氧化物的化学式是SeO2 |
1.下列说法正确的是( )
| A. | 碘单质能升华是由于碘单质分子间的键能较小 | |
| B. | 键能越大,则含该键的分子受热越易分解为原子 | |
| C. | 燃料燃烧过程中,反应物的总能量总是高于生成物的总能量 | |
| D. | H-Cl键的键能为431kJ•mol-1,H-I键的键能为299kJ•mol-1,这说明HCl分子比HI分子稳定 |
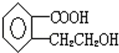 1mol该有机物可以跟1molNaHCO3反应,1mol该有机物可以跟1mol NaOH反应.1mol该有机物可以跟3mol氢气反应.
1mol该有机物可以跟1molNaHCO3反应,1mol该有机物可以跟1mol NaOH反应.1mol该有机物可以跟3mol氢气反应.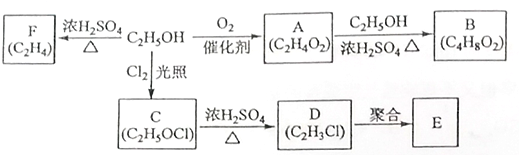
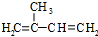 $\stackrel{一定条件}{→}$
$\stackrel{一定条件}{→}$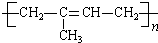 .
. .
.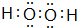 .
.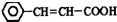 ,可由化合物甲生成.其转化关系及相应反应如下:
,可由化合物甲生成.其转化关系及相应反应如下: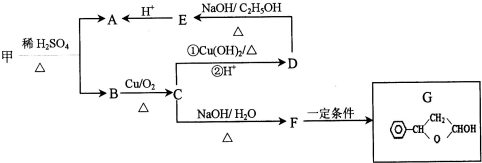

 .
. (写结构简式);立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为
(写结构简式);立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为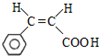 .
.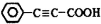 是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成的
是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成的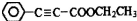 路线(其他试剂任选)
路线(其他试剂任选)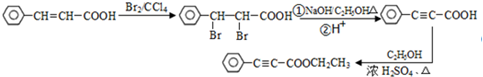 .
.