题目内容
13.关于下列各装置图的叙述中,正确的是( )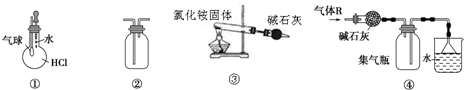
| A. | 装置①可验证HCl气体在水中的溶解性 | |
| B. | 装置②可用排空气法收集H2、NH3、Cl2、HCl、CO2等气体 | |
| C. | 装置③实验室用氯化铵制少量氨气 | |
| D. | 装置④可用于干燥、收集氯化氢,并吸收多余的氯化氢 |
分析 A.HCl极易溶于水,挤压胶头滴管,瓶内气体减少;
B.导管长进短出收集密度比空气密度大的气体,导管短进长出收集密度比空气密度小的气体;
C.氯化铵分解后,在试管口又化合生成氯化铵;
D.HCl与碱石灰反应,且HCl的密度比空气密度大.
解答 解:A.HCl极易溶于水,挤压胶头滴管,瓶内气体减少,则气球变大可说明HCl气体在水中的溶解性,故A正确;
B.导管长进短出收集Cl2、HCl、CO2等气体,导管短进长出收集H2、NH3气体,故B正确;
C.氯化铵分解后,在试管口又化合生成氯化铵,不能制备氨气,应利用铵盐与碱加热制备,故C错误;
D.HCl与碱石灰反应,且HCl的密度比空气密度大,则不能利用碱石灰干燥,且收集方法不合理,故D错误;
故选AB.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、常见气体的制备实验、实验技能为解答的关键,侧重分析与实验能力的考查,注意实验装置的作用及实验评价性分析,题目难度中等.

练习册系列答案
相关题目
1.下列说法正确的是( )
| A. | 碘单质能升华是由于碘单质分子间的键能较小 | |
| B. | 键能越大,则含该键的分子受热越易分解为原子 | |
| C. | 燃料燃烧过程中,反应物的总能量总是高于生成物的总能量 | |
| D. | H-Cl键的键能为431kJ•mol-1,H-I键的键能为299kJ•mol-1,这说明HCl分子比HI分子稳定 |
18.某有机化合物,只含碳、氢、氧三种元素中的两种或三种,相对分子质量为74,完全燃烧时产生等物质的量的CO2和H2O.它的分子式可能为( )
| A. | C4H10O | B. | C4H4O2 | C. | C3H6O2 | D. | C4H8O2 |
5.已知断开1molH-H键吸收的能量为436KJ,形成1molH-H键放出的能量为391KJ,根据化学方程式N2+3H2$?_{高温,高压}^{催化剂}$2NH3,反应完1molN2放出的能量为924KJ,则断开1molN=N键吸收的能量是( )
| A. | 431KJ | B. | 649KJ | C. | 869KJ | D. | 945.6KJ |
2.表是元素周期表的一部分,针对表中的①~⑩种元素,填写下列空白:
(1)在最高价氧化物的水化物中,酸性最强的化合物的分子式是:HClO4,碱性最强的化合物的电子式是: .
.
(2)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(3)用电子式表示元素④与⑥的化合物的形成过程:
(4)表示①与⑦的化合物的电子式 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.
(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-(要求用离子符号表示).
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为:Cl2+H2O=HClO+H++Cl-.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0族 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
 .
.(2)最高价氧化物是两性氧化物的元素是Al;写出它的氧化物与氢氧化钠反应的离子方程式Al2O3+2OH-=2AlO2-+H2O.
(3)用电子式表示元素④与⑥的化合物的形成过程:

(4)表示①与⑦的化合物的电子式
 ,该化合物是由极性(填“极性”“非极性”)键形成的.
,该化合物是由极性(填“极性”“非极性”)键形成的.(5)③、⑥、⑦三种元素形成的离子,离子半径由大到小的顺序是S2->Cl->O2-(要求用离子符号表示).
(6)元素③的氢化物常温下和元素⑦的单质反应的离子方程式为:Cl2+H2O=HClO+H++Cl-.
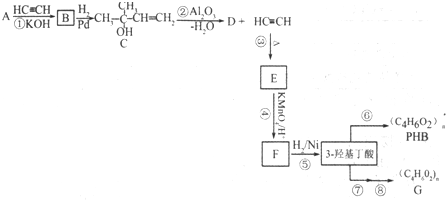
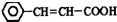 ,可由化合物甲生成.其转化关系及相应反应如下:
,可由化合物甲生成.其转化关系及相应反应如下: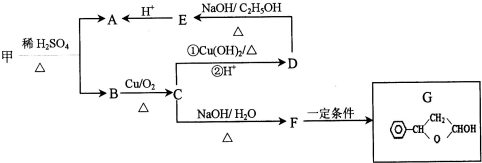

 .
. (写结构简式);立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为
(写结构简式);立体异构中有一种形式为顺反异构,当相同原子或基团在双键平面同一侧时为顺式结构,在异侧时为反式结构,则A的顺式结构简式为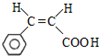 .
.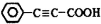 是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成的
是重要的有机合成工业中间体之一,广泛用于医药、香料、塑料和感光树脂等化工产品,参照上述反应路线,设计一条以A为原料合成的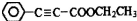 路线(其他试剂任选)
路线(其他试剂任选)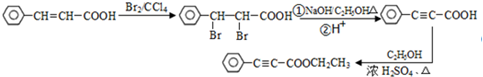 .
.
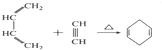
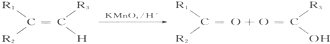
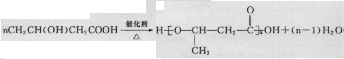
 B.
B.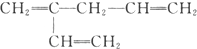 C.
C.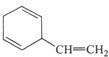 D.
D.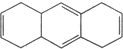
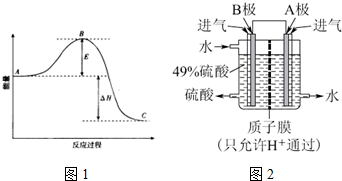
 .
.