题目内容
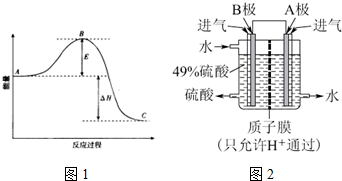
13.用下列装置进行的相应实验能达到实验目的是( )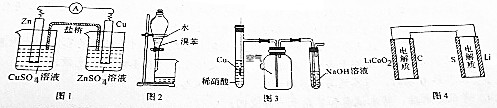
| A. | 图1装置设计铜锌双液原电池 | |
| B. | 图2装置用于分离水和溴苯的混合物 | |
| C. | 图3装置用于制备并收集NO气体 | |
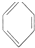
| D. | 图4装置锂硫电池(2Li+S$?_{充电}^{放电}$Li2S)给锂离子电池充电(LixC+Li1-xCo2$?_{充电}^{放电}$C+LiCoO2) |
分析 A.含有盐桥的原电池中,电极材料与其相对应的电解质具有相同的金属元素;
B.互不相溶的液体采用分液方法分离,互溶的液体采用蒸馏方法分离;
C.NO不属于水,但易被氧气氧化生成二氧化氮;
D.给电池充电时,负极与外接电源的负极相连,正极与外接电源的正极相连.
解答 解:A.含有盐桥的原电池中,电极材料与其相对应的电解质具有相同的金属元素,所以要使该装置构成原电池,则两个电极应该互换,否则不能构成原电池,故A错误;
B.互不相溶的液体采用分液方法分离,互溶的液体采用蒸馏方法分离,溴苯和水不互溶,则可以采用分液方法分离,故B正确;
C.NO不属于水,但易被氧气氧化生成二氧化氮,则应该采用排水法收集NO,故C错误;
D.图中表示锂硫电池给锂离子电池充电,右边电极材料是Li和S,锂负极,硫为正极,左边电极材料是C和LiCoO2,由锂离子电池的总反方程式可知C+LiCoO2→LixC+Li1-xCoO2为充电过程即为电解池,则锂硫电池给锂离子电池充电,LiCoO2为阳极失电子发生氧化反应:LiCoO2-xe--xLi+=Li1-xCoO2;C为阴极得电子发生还原反应:
C+xe-+xLi+=LixC,则C与负极Li相连,LiCoO2应与正极S相连,故D错误;
故选B.
点评 本题考查化学实验方案评价,为高频考点,涉及原电池原理、气体的收集、物质分离和提纯等知识点,明确实验原理、物质性质、实验基本操作是解本题关键,D选项是解答本题难点,题目难度中等.

练习册系列答案
 每日10分钟口算心算速算天天练系列答案
每日10分钟口算心算速算天天练系列答案
相关题目
3.含有元素硒(Se)的保健品已开始进入市场.已知它与氧同族,与钾同周期.则下列关于硒的叙述中,正确的是( )
| A. | 非金属性比硫强 | B. | 气态氢化物的化学式为H2Se | ||
| C. | 酸性:H2SeO4>H2SO4 | D. | 最高价氧化物的化学式是SeO2 |
1.下列说法正确的是( )
| A. | 碘单质能升华是由于碘单质分子间的键能较小 | |
| B. | 键能越大,则含该键的分子受热越易分解为原子 | |
| C. | 燃料燃烧过程中,反应物的总能量总是高于生成物的总能量 | |
| D. | H-Cl键的键能为431kJ•mol-1,H-I键的键能为299kJ•mol-1,这说明HCl分子比HI分子稳定 |
5.已知断开1molH-H键吸收的能量为436KJ,形成1molH-H键放出的能量为391KJ,根据化学方程式N2+3H2$?_{高温,高压}^{催化剂}$2NH3,反应完1molN2放出的能量为924KJ,则断开1molN=N键吸收的能量是( )
| A. | 431KJ | B. | 649KJ | C. | 869KJ | D. | 945.6KJ |
6.已知:实验室常用无水乙醇(CH3CH2OH)制备乙烯,制备原理为:CH3CH2OH$→_{170℃}^{浓硫酸}$CH2=CH2↑+H2O.
无水乙醇性质如表:
甲、乙同学用下列实验装置制备乙烯并验证其性质.(气密性已检验,部分夹持装置略).

实验操作和现象:
(1)写出乙烯的1个用途:制塑料,对应方程式为(注明反应类型) ,加聚反应.
,加聚反应.
(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有脱水性.
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型)CH2=CH2+Br2→CH2BrCH2Br,加成反应.
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种“有刺激性气味”的气体X.你认为这种“有刺激性气味”气体X是SO2(填化学式).
为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
请回答下列问题:
D中盛放的试剂是NaOH(填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释):5C2H4+4MnO4-+12H+→10CO2↑+4Mn2++16H2O.
无水乙醇性质如表:
| 物质 | 熔点/℃ | 沸点/℃ | 溶解性 | 挥发性 | 化学性质 |
| 无水乙醇 | -114.1 | 78.3 | 能与水以任意比互溶 | 易挥发 | 能使酸性高锰酸钾溶液褪色 |

实验操作和现象:
| 操 作 | 现 象 |
| 点燃酒精灯,加热至170℃ | I:A中烧瓶内液体渐渐变黑 II:B内气泡连续冒出,溶液逐渐褪色 |
| … | |
| 实验完毕,清洗烧瓶 | III:A中烧瓶内附着少量黑色颗粒状物,有刺激性气味逸出 |
 ,加聚反应.
,加聚反应.(2)A中烧瓶内溶液“渐渐变黑”,说明浓硫酸具有脱水性.
(3)分析使B中溶液褪色的物质,甲认为是C2H4使B中溶液褪色,该反应的化学方程式为(注明反应类型)CH2=CH2+Br2→CH2BrCH2Br,加成反应.
(4)乙根据反应原理及现象I和III综合分析,认为产物中除乙烯外还混有乙醇、H2O、CO2和一种“有刺激性气味”的气体X.你认为这种“有刺激性气味”气体X是SO2(填化学式).
为验证气体X的存在,并证实是C2H4使B中溶液褪色,乙设计如下装置,与A连接:
| 设 计 | 现 象 |
与A连接的装置如下: | C中溶液褪色,加热后又恢复红色; F中溶液褪色 |
D中盛放的试剂是NaOH(填化学式),不能盛放酸性KMnO4溶液的原因是(用离子方程式解释):5C2H4+4MnO4-+12H+→10CO2↑+4Mn2++16H2O.
 .
.
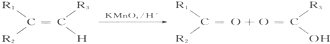
 B.
B.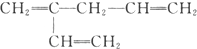 C.
C. D.
D.