题目内容
19.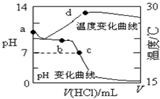 室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )
室温下,将1.000mol/L盐酸滴入20.00mL1.000mol/L氨水中,溶液pH和温度随加入盐酸体积变化曲线如图所示.下列有关说法正确的是( )| A. | a点由水电离出的c(H+)=1.0×10-14mol/L | |
| B. | b点时c(NH4+)+c(NH3•H2O)=c(Cl-) | |
| C. | c点时消耗的盐酸体积:V(HCl)<20.00mL | |
| D. | d点后,溶液温度略下降的主要原因是NH3•H2O电离吸热 |
分析 A.一水合氨是弱电解质,在水溶液中部分电离生成氢氧根离子而抑制水电离,因为其电离度未知而无法计算溶液中c(OH-),根据c(OH-).c(H+)=Kw判断;
B.根据图知,b点溶液pH>7,溶液呈碱性,溶液中溶质为一水合氨和氯化铵,说明加入的n(HCl)小于氨水的物质的量;
C.氯化铵是强酸弱碱盐,其水溶液呈酸性,要使氨水、盐酸混合溶液呈中性,则氨水应该稍微过量;
D.d点温度最高,说明该点酸碱恰好完全反应生成氯化铵,然后再加入HCl,溶液中溶质为氯化铵和HCl,铵根离子水解是吸热反应.
解答 解:A.一水合氨是弱电解质,在水溶液中部分电离生成氢氧根离子而抑制水电离,因为其电离度未知而无法计算溶液中c(OH-),根据c(OH-).c(H+)=Kw知,无法计算水电离出的c(H+),故A错误;
B.根据图知,b点溶液pH>7,溶液呈碱性,溶液中溶质为一水合氨和氯化铵,说明加入的n(HCl)小于氨水的物质的量,根据物料守恒得c(NH4+)+c(NH3•H2O)>c(Cl-),故B错误;
C.氯化铵是强酸弱碱盐,其水溶液呈酸性,要使氨水、盐酸混合溶液呈中性,则氨水应该稍微过量,二者的浓度相等,所以V(HCl)小于氨水体积,即小于20.00mL,故C正确;
D.d点温度最高,说明该点酸碱恰好完全反应生成氯化铵,然后再加入HCl,溶液中溶质为氯化铵和HCl,铵根离子水解是吸热反应,所以d点后,溶液温度略下降的主要原因是NH4+水解吸热,故D错误;
故选C.
点评 本题考查酸碱混合溶液定性判断,为高频考点,侧重考查学生识图能力及分析判断能力,明确混合溶液中溶质成分及其性质是解本题关键,注意:一水合氨电离和铵根离子水解都吸收热量,注意酸或碱溶液中水电离出的c(OH-)、c(H+)计算方法,为易错点.

 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案| A. | C6H12O6$\stackrel{酒化酶}{→}$2C2H6O+2CO2↑ | B. | CH4+Cl2$\stackrel{光照}{→}$CH3Cl+HCl | ||
| C. | HC≡CH+HCl$\stackrel{一定条件}{→}$CH2=CHCl | D. | 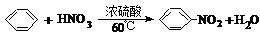 |
| A. | 油脂 | B. | 葡萄糖 | C. | 蛋白质 | D. | 聚氯乙烯 |
| A. | 向CuSO4溶液中投入Na:Cu2++2Na═Cu+2Na+ | |
| B. | 向FeCl3溶液中滴加KSCN溶液:Fe3++3SCN-═Fe(SCN)3↓ | |
| C. | 用氨水溶解Cu(OH)2:Cu(OH)2+4NH3•H2O═[Cu(NH3)4]2++2OH-+4H2O | |
| D. | 向BaCO3固体中加入过量的稀H2SO4:BaCO3+2H+═Ba2++CO2↑+H2O |
| A. | 某溶液中加入BaCl2溶液,有白色沉淀生成,再加入稀盐酸沉淀不溶解,说明原溶液中一定含SO42- | |
| B. | 将含有SO2杂质的CO2气体,缓慢通过足量的高锰酸钾溶液,再通过浓硫酸干燥,可获得较纯净的CO2气体 | |
| C. | 某钠盐(含NaHCO3、Na2CO3中的一种或两种)试样0.168 g,将其灼烧,冷却,并用托盘天平称量残留固体的质量,根据质量是否变化,可确定样品的组成 | |
| D. | 铝热反应可生成铁,工业上可大量利用该反应来生产铁 |
| A. | NaCl、NaOH、NH4NO3、CaCO3 | B. | FeCl3、CuSO4、Mg(OH)2、NaCl | ||
| C. | BaSO4、AgCl、KOH、NH4Cl | D. | NH4HCO3、MgCl2、BaCl2、Ba(NO3)2 |
 ⑤-CHO.
⑤-CHO.