题目内容
8.一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)?C(g)+D(l),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B的物质的量浓度.
| A. | ①②③④ | B. | ②③ | C. | ②③④ | D. | 只有④ |
分析 可逆反应达到平衡状态时,正逆反应速率相等,反应体系中各物质的物质的量不变、物质的量浓度不变、百分含量不变以及由此引起的一系列物理量不变,据此分析解答.
解答 解:①反应前后气体的质量改变、容器体积不变,所以反应前后气体密度改变,当混合气体的密度不变时,各物质的物质的量不变,该反应达到平衡状态,故正确;
②反应前后气体的物质的量减小,则压强减小,当容器内气体的压强不变时,正逆反应速率相等,反应达到平衡状态,故正确;
③反应前后气体的物质的量减少,当混合气体的总物质的量不变时,该物质的物质的量不变,该反应达到平衡状态,故正确;
④反应前后B的物质的量减小,容器体积不变,所以反应前后B的物质的量浓度减小,当B的物质的量浓度不变时,该反应达到平衡状态,故正确;
故选A.
点评 本题考查化学平衡状态判断方法,为高频考点,只有反应前后改变的物理量才能作为平衡状态判断依据,注意正确选取合适的物理量判断化学平衡状态,题目难度不大.

练习册系列答案
相关题目
19.下列说法正确的是( )
| A. | 如果5.6LN2含有n个氮分子,则NA一定约为4n | |
| B. | 18g水中所含的电子数是8NA | |
| C. | 在0.5mol/L的氯化钡溶液中含有离子数为1.5NA | |
| D. | 15gCH3+含有8mol电子 |
16.下列选项中能表示阿伏加德罗常数数值的是( )
| A. | 1mol H+含有的电子数 | |
| B. | 标准状况下,22.4L酒精所含的分子数 | |
| C. | 1.6 g CH4 含有的质子数 | |
| D. | 1L 1mol/L的硫酸钠溶液所含的Na+ 数 |
13.下列各组离子中,在酸性溶液中能大量共存且溶液为无色透明的是( )
| A. | Na+、Cu2+、Cl-、SO42- | B. | Na+、HCO3-、Cl-、NO3- | ||
| C. | Na+、SO32-、NO3-、K+ | D. | K+、SO42-、Mg2+、Cl- |
20.已知:P4(s)+6Cl2(g)═4PCl3(g)△H=a kJ•mol-1
P4(s)+10Cl2(g)═4PCl5(g)△H=b kJ•mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ•mol-1,PCl3中
P-Cl键的键能为1.2c kJ•mol-1,列叙述正确的是( )
P4(s)+10Cl2(g)═4PCl5(g)△H=b kJ•mol-1
P4具有正四面体结构,PCl5中P-Cl键的键能为c kJ•mol-1,PCl3中
P-Cl键的键能为1.2c kJ•mol-1,列叙述正确的是( )
| A. | P-P键的键能大于P-Cl键的键能 | |
| B. | 可求Cl2(g)+PCl3(g)═PCl5(s)的反应热△H | |
| C. | Cl-Cl键的键能$\frac{b-a+5.6c}{4}$ kJ•mol-1 | |
| D. | 1molP4含4molp-p键 |
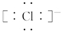 .Al在元素周期表最中的位置是第三周期第IIIA族.
.Al在元素周期表最中的位置是第三周期第IIIA族.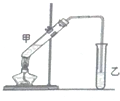 俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题:
俗话说,“陈酒老醋特别香”,其原因是酒在储存过程中生成了有香味的乙酸乙酯,在实验室里我们也可以用如图所示的装置来模拟该过程.请回答下列问题: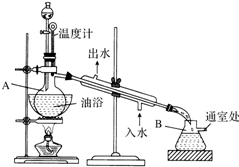 乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,某次制取实验用到冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:
乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,某次制取实验用到冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是: