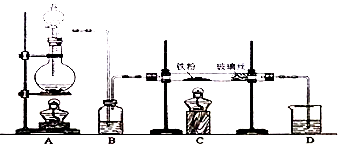
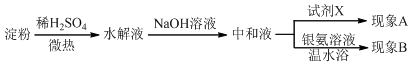
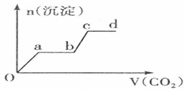
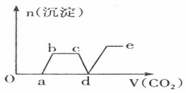
题目内容
3.一定条件下,向含硝酸的废水中加入CH3OH,将HNO3还原成N2.若参加反应的还原剂和氧化剂的物质的量之比是5:6,则该反应的氧化产物是CO2;每转移3mol电子,反应消耗16 g CH3OH.分析 一定条件下,向含硝酸的废水中加入CH3OH,将HNO3还原成N2,则CH3OH为还原剂,HNO3为氧化剂,已知还原剂和氧化剂的物质的量之比是5:6,据此写出方程式,然后计算.
解答 解:一定条件下,向含硝酸的废水中加入CH3OH,将HNO3还原成N2,则CH3OH为还原剂,HNO3为氧化剂,已知还原剂和氧化剂的物质的量之比是5:6,根据质量守恒和化合价升降总数相等得:5CH3OH+6HNO3═5CO2+3N2+13H2O,所以氧化产物为CO2,消耗5mol甲醇转移30mol电子,所以当每转移3mol电子消耗0.5mol甲醇,其质量为16g;
故答案为:CO2;16.
点评 本题考查氧化还原反应的计算,侧重于学生的分析能力和计算能力的考查,注意从元素化合价的角度解答该题,难度中等.

练习册系列答案
 波波熊暑假作业江西人民出版社系列答案
波波熊暑假作业江西人民出版社系列答案 学而优暑期衔接南京大学出版社系列答案
学而优暑期衔接南京大学出版社系列答案 Happy holiday欢乐假期暑假作业广东人民出版社系列答案
Happy holiday欢乐假期暑假作业广东人民出版社系列答案
相关题目
11.在一个密闭的容器中,含有甲烷1.6g和氧气8.0g.燃烧反应完全后,则容器中所含的分子总物质的量为多少mol( )
| A. | 0.20 | B. | 0.25 | C. | 0.30 | D. | 0.35 |
18.已知反应①101kPa时,2C(s)+O2(g)═2CO(g)△H=-221kJ/mol ②稀溶液中,H+(aq)+OHˉ(aq)═H2O(l);△H=-57.3kJ/mol下列结论正确的是( )
| A. | 碳的燃烧热大于110.5 kJ/mol | |
| B. | ①反应的焓变为-221 kJ/mol | |
| C. | 稀硫酸与稀NaOH溶液反应的中和热为-57.3 kJ/mol | |
| D. | 稀醋酸与稀NaOH溶液反应生成1 mol水,放出57.3 kJ热量 |
8.一定温度下在容积恒定的密闭容器中,进行如下可逆反应:A(s)+2B(g)?C(g)+D(l),当下列物理量不发生变化时,能表明该反应已达到平衡状态的是( )
①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B的物质的量浓度.
①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B的物质的量浓度.
| A. | ①②③④ | B. | ②③ | C. | ②③④ | D. | 只有④ |
5.比较纯碱的两种工业制法,正确的是( )
| 选项 | 项目 | 氨碱法 | 联合制碱法 |
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 可能的副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氨气、氯化钠 |
| D. | 评价 | 原料易得、产率高 | 设备简单、能耗低 |
| A. | A | B. | B | C. | C | D. | D |