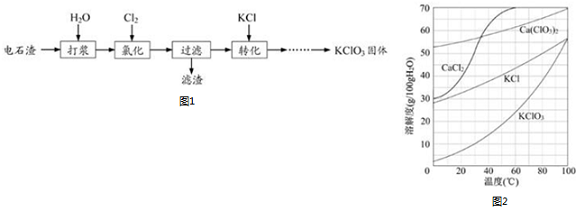
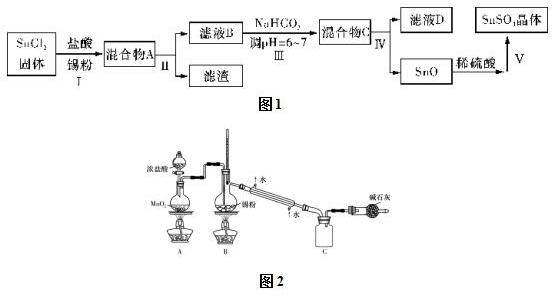
题目内容
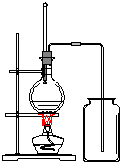
10.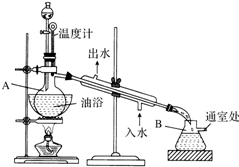 乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,某次制取实验用到冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:
乙酸乙酯是无色的有水果香味的液体,沸点77.1℃,某次制取实验用到冰醋酸14.3mL,95%乙醇23mL,还用到浓H2SO4,饱和Na2CO3溶液以及极易与乙醇结合成六醇合物的氯化钙溶液,主要仪器装置如图所示,实验步骤是:①先向A蒸馏烧瓶中注入少量乙醇和所用的浓H2SO4后摇匀,再将剩下的所有乙醇和冰醋酸注入分液漏斗待用,这时分液漏斗里乙醇与冰醋酸的物质的量之比约为7:5;
②加热油浴,保持温度在135℃~145℃之间;
③将分液漏斗中的液体缓缓滴入蒸馏烧瓶里,调节加料速度使蒸出酯的速度与进料速度大体相等,直到加料完成;
④保持油浴温度一段时间,至不再有液体馏出后,停止加热;
⑤取下B吸滤瓶,将一定量饱和Na2CO3溶液分批少量多次地加到馏出液里,边加边摇荡,直到无气泡产生为止;
⑥将⑤的液体混合物分液,弃去水层;
⑦将饱和CaCl2溶液(适量)加入到分液漏斗中,摇荡一段时间静置,放出水层(废液);
⑧分液漏斗里得到的是初步提纯的乙酸乙酯粗品;
⑨然后再向其中加入无水硫酸钠,振荡.
试回答:
(1)写出用冰醋酸制乙酸乙酯的方程式CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O.
(2)用过量乙醇的主要目的是增大反应物乙醇的浓度,有利于反应向生成乙酸乙酯的方向进行,边加料,边加热蒸馏的目的是减小生成物乙酸乙酯的浓度,有利于反应向酯化方向进行.
(3)用饱和Na2CO3溶液洗涤粗酯的目的是中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度,如果用NaOH浓溶液代替Na2CO3,将引起的后果是致使乙酸乙酯水解.
(4)用饱和CaCl2溶液洗涤粗酯的目的是除去粗酯中的乙醇.
(5)为什么操作③要使加料与馏出的速度大致相等使反应充分且能够及时冷凝蒸出产物.
(6)加入无水硫酸钠,其目的是除去粗产品中的水.
分析 (1)乙酸和乙醇在浓硫酸作用下发生酯化反应生成乙酸乙酯;
(2)乙醇过量可促进乙酸的转化,边加料,边加热蒸馏,分离出乙酸乙酯,利用平衡正向移动;
(3)饱和碳酸钠溶液吸收乙醇、除去乙酸,降低乙酸乙酯的溶解度;用NaOH浓溶液代替Na2CO3,乙酸乙酯发生水解;
(4)饱和CaCl2溶液洗涤粗酯,可吸收乙醇,与乙酸乙酯分层;
(5)保持蒸馏烧瓶中压强一定,得到平稳的蒸气气流;
(6)无水硫酸钠具有吸水性.
解答 解:(1)乙酸与乙醇在浓硫酸作用下加热发生酯化反应生成乙酸乙酯和水,反应的方程式为CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O,
故答案为:CH3COOH+C2H5OH$?_{△}^{浓硫酸}$CH3COOC2H5+H2O;
(2)用过量乙醇的主要目的是增大反应物乙醇的浓度,有利于反应向生成乙酸乙酯的方向进行,边加料,边加热蒸馏的目的是减小生成物乙酸乙酯的浓度,有利于反应向酯化方向进行,
故答案为:增大反应物乙醇的浓度,有利于反应向生成乙酸乙酯的方向进行;减小生成物乙酸乙酯的浓度,有利于反应向酯化方向进行;
(3)制备乙酸乙酯时常用饱和碳酸钠溶液,目的是中和挥发出来的乙酸,使之转化为乙酸钠溶于水中,便于闻乙酸乙酯的香味;溶解挥发出来的乙醇;降低乙酸乙酯在水中的溶解度,便于分层得到酯;乙酸乙酯在强碱性条件下发生水解反应,
故答案为:中和乙酸、溶解乙醇,降低乙酸乙酯的溶解度;致使乙酸乙酯水解;
(4)饱和CaCl2溶液可以吸收乙酸乙酯中可能残留的乙醇,这样分离出的粗酯中只含有水了,
故答案为:除去粗酯中的乙醇;
(5)加料与馏出的速度大致相等,可让产生的乙酸乙酯及时蒸馏出来,保持蒸馏烧瓶中压强一定,得到平稳的蒸气气流,
故答案为:使反应充分且能够及时冷凝蒸出产物;
(6)加入无水硫酸钠,其目的是除去粗产品中的水,
故答案为:除去粗产品中的水.
点评 本题考查有机物的制备实验,为高频考点,把握制备原理、混合物分离提纯、化学平衡移动为解答的关键,侧重分析与应用能力的考查,注意有机物性质的应用,题目难度不大.

 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案①混合气体的密度 ②容器内气体的压强 ③混合气体的总物质的量④B的物质的量浓度.
| A. | ①②③④ | B. | ②③ | C. | ②③④ | D. | 只有④ |
| 选项 | 项目 | 氨碱法 | 联合制碱法 |
| A. | 原料 | 食盐、氨气、生石灰 | 食盐、氨气、二氧化碳 |
| B. | 可能的副产物 | 氯化钙 | 氯化铵 |
| C. | 循环物质 | 氨气、二氧化碳 | 氨气、氯化钠 |
| D. | 评价 | 原料易得、产率高 | 设备简单、能耗低 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 麻古(冰毒片剂) | B. | K粉(氯胺酮) | C. | 大麻(四氢大麻酚) | D. | 抗酸药 |
 实验室是用乙醇在浓硫酸和170℃条件下制取乙烯的.
实验室是用乙醇在浓硫酸和170℃条件下制取乙烯的.