题目内容
11.在常温、常压下,将等物质的量的氢气和氧气充入一个密闭容器中,经点燃后充分反应后,容器的压强为反应前的0.25倍.(容器体积不变).分析 发生反应为2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O,常温常压下水为液态,设出氢气和氧气的物质的量,然后计算出反应后剩余气体的物质的量,最后根据容器内压强与气体的物质的量成正比计算出反应前后压强关系.
解答 解:常温常压下水为液态,设氢气和氧气的物质的量都为nmol,反应前气体的总物质的量为2nmol;
根据反应2H2+O2$\frac{\underline{\;点燃\;}}{\;}$2H2O可知,氧气过量,反应后剩余气体的物质的量为:nmol-$\frac{1}{2}$nmol=0.5nmol,
容器容积不变,根据PV=nRT可知容器中压强与气体总物质的量成正比,所以反应后容器内压强为反应前压强的$\frac{0.5nmol}{2nmol}$=0.25倍,
故答案为:0.25.
点评 本题考查了物质的量的计算,题目难度不大,明确发生反应实质为为解答关键,注意掌握气体压强与物质的量的关系,试题培养了学生的化学计算能力.

练习册系列答案
相关题目
19.在下列实验操作中,不能达到目的是( )
| A. | 向某溶液中加入氯水,然后加入KSCN溶液,检验该溶液中是否含有Fe2+ | |
| B. | 向偏铝酸钠溶液中通入过量CO2,制备氢氧化铝 | |
| C. | 用金属钠分别与水和乙醇反应,比较水和乙醇分子中羟基氢(-OH)的活泼性 | |
| D. | 用检验Na2CO3和Na2SO4水溶液酸碱性实验,证明碳和硫两元素非金属性的强弱. |
3.下列说法正确的是( )
| A. | 食用白糖的主要成分是葡萄糖 | |
| B. | 淀粉溶液和蛋白质溶液都有丁达尔效应 | |
| C. | 油脂、淀粉和纤维素都是人体的重要营养物质 | |
| D. | 植物油的主要成分是高级脂肪酸 |
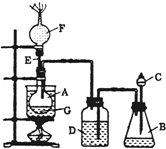 为了证明乙醇分子中含有氧原子,某小组设计了如图装置进行 实验研究.图中烧杯A用作水浴器,锥形瓶B中盛有试剂X,分液漏斗C和广口瓶D中均盛有浓硫酸,E是一根直导管,干燥管F中填满新制的碱石灰,烧瓶G中装有无水乙醇和一些新制白色无水盐粉末Y.打开C处活塞,将浓硫酸慢慢滴入B中与试剂X作用,之后发现D瓶的导管口产生大量气泡,水浴加热G瓶,不久又观察到G瓶中试剂Y变色,F端排出的气体经净化后还能点燃.请回答下列问题:
为了证明乙醇分子中含有氧原子,某小组设计了如图装置进行 实验研究.图中烧杯A用作水浴器,锥形瓶B中盛有试剂X,分液漏斗C和广口瓶D中均盛有浓硫酸,E是一根直导管,干燥管F中填满新制的碱石灰,烧瓶G中装有无水乙醇和一些新制白色无水盐粉末Y.打开C处活塞,将浓硫酸慢慢滴入B中与试剂X作用,之后发现D瓶的导管口产生大量气泡,水浴加热G瓶,不久又观察到G瓶中试剂Y变色,F端排出的气体经净化后还能点燃.请回答下列问题: 实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有:
实验室配制500mL 0.2mol•L-1的Na2SO4溶液,实验操作步骤有: