题目内容
黑火药是中国古代四大发明之一,它的爆炸反应为:2KNO3+3C+S
A+N2↑+3CO2↑(已配平)
(1)生成物中除了氮气与二氧化碳外,还有一种物质A生成,则A的电子式为 ,A属于 晶体.
(2)制药,其氧化物可用于漂白织物和防腐剂,该元素在周期表中的位置是 ,该元素的原子核外有 种不同运动状态的电子.
(3)黑火药中所含元素的原子半径从大到小的顺序是 (用元素符号表示);
(4)下列事实能说明黑火药中碳与硫两元素非金属性相对强弱的有 .
A.同条件同浓度溶液pH:Na2CO3>Na2SO4
B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
D.分解温度:CH4>H2S.
| 引燃 |
(1)生成物中除了氮气与二氧化碳外,还有一种物质A生成,则A的电子式为
(2)制药,其氧化物可用于漂白织物和防腐剂,该元素在周期表中的位置是
(3)黑火药中所含元素的原子半径从大到小的顺序是
(4)下列事实能说明黑火药中碳与硫两元素非金属性相对强弱的有
A.同条件同浓度溶液pH:Na2CO3>Na2SO4
B.酸性:H2SO3>H2CO3
C.CS2中碳元素为+4价,硫元素为-2价
D.分解温度:CH4>H2S.
考点:氧化还原反应,元素周期表的结构及其应用,非金属在元素周期表中的位置及其性质递变的规律
专题:氧化还原反应专题
分析:(1)由原子守恒可知,A为K2S,为离子化合物;
(2)C、N、O、S、K中,氧化物可用于漂白织物和防腐剂,为S的氧化物,S的原子核外电子数为16;
(3)电子层越多,半径越大;同周期原子序数大的半径小;
(4)A.元素最高价氧化物对应水化物的酸性越强,则元素的非金属性越强;
B.亚硫酸不是硫元素的最高价氧化物对应的水化物;
C.非金属性强的元素显示负价,非金属性弱的则显示正价;
D.一般来说,元素的气态氢化物越稳定,则元素的非金属性越强.
(2)C、N、O、S、K中,氧化物可用于漂白织物和防腐剂,为S的氧化物,S的原子核外电子数为16;
(3)电子层越多,半径越大;同周期原子序数大的半径小;
(4)A.元素最高价氧化物对应水化物的酸性越强,则元素的非金属性越强;
B.亚硫酸不是硫元素的最高价氧化物对应的水化物;
C.非金属性强的元素显示负价,非金属性弱的则显示正价;
D.一般来说,元素的气态氢化物越稳定,则元素的非金属性越强.
解答:
解:(1)由原子守恒可知,A为K2S,只含离子键,为离子晶体,其电子式为 ,故答案为:
,故答案为: ;离子;
;离子;
(2)C、N、O、S、K中,氧化物可用于漂白织物和防腐剂,为S的氧化物,S位于第三周期第VIA族,S的原子核外电子数为16,则有16种不同运动状态的电子,
故答案为:第三周期第VIA族;16;
(3)电子层越多,半径越大;同周期原子序数大的半径小,则原子半径由大到小为K>S>C>N>O,故答案为:K>S>C>N>O;
(4)A.Na2CO3水解呈碱性,说明H2CO3是弱酸,Na2SO4不水解,H2SO4是强酸,所以H2SO4的酸性强于H2CO3的,则能说明碳与硫两元素非金属性为S>C,故A选;
B.亚硫酸强于碳酸,说明亚硫酸电离出氢离子的能力强于硫酸,不能说明碳与硫两元素非金属性相对强弱,故B不选;
C.直接说明S的非金属性强于C,所以S才显负价,碳元素显示正价,故C选;
D.氢化物的稳定性顺序是CH4>H2S,但S的非金属性强于碳元素,故D不选;
故答案为:AC.
 ,故答案为:
,故答案为: ;离子;
;离子;(2)C、N、O、S、K中,氧化物可用于漂白织物和防腐剂,为S的氧化物,S位于第三周期第VIA族,S的原子核外电子数为16,则有16种不同运动状态的电子,
故答案为:第三周期第VIA族;16;
(3)电子层越多,半径越大;同周期原子序数大的半径小,则原子半径由大到小为K>S>C>N>O,故答案为:K>S>C>N>O;
(4)A.Na2CO3水解呈碱性,说明H2CO3是弱酸,Na2SO4不水解,H2SO4是强酸,所以H2SO4的酸性强于H2CO3的,则能说明碳与硫两元素非金属性为S>C,故A选;
B.亚硫酸强于碳酸,说明亚硫酸电离出氢离子的能力强于硫酸,不能说明碳与硫两元素非金属性相对强弱,故B不选;
C.直接说明S的非金属性强于C,所以S才显负价,碳元素显示正价,故C选;
D.氢化物的稳定性顺序是CH4>H2S,但S的非金属性强于碳元素,故D不选;
故答案为:AC.
点评:本题考查较综合,涉及氧化还原反应、元素的位置及性质、非金属性的比较等,综合性较强,注重高频考点的考查,有利于基础知识的夯实,题目难度不大.

练习册系列答案
相关题目
下列各组离子在指定溶液中一定能大量共存的是( )
| A、能使甲基橙呈红色的溶液:Ba2+、Al3+、NO3-、Cl- |
| B、由水电离出的c(H+)=1×10-11 mol?L-1溶液:Na+、Mg2+、Cl-、NO3- |
| C、0.2 mol?L-1的NaNO3溶液:H+、Fe2+、SO42-、Cl- |
| D、与Fe反应生成H2的溶液:NH4+、K+、SO42-、CO32- |
用NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A、1 mol N2所含有的原子数为NA |
| B、标准状况下,22.4 L水中含有的水分子数为NA |
| C、标准状况下,22.4 L氯化氢所含的原子数为NA |
| D、32 g O2所含的氧原子数目为2NA |
升高温度,下列数据不一定增大的是( )
| A、化学反应速率v |
| B、水的离子积常数Kw |
| C、化学平衡常数K |
| D、弱酸的电离平衡常数Ki |
下列试剂不能长期贮存在玻璃瓶中的是( )
| A、浓盐酸 | B、浓硫酸 |
| C、浓氢氧化钠溶液 | D、浓食盐水 |
下列关于硫及其化合物的叙述,正确的是( )
| A、硫黄是一种易溶于水的黄色晶体 |
| B、SO2的水溶液显酸性 |
| C、SO2是黄色易溶于水的有毒气体 |
| D、SO2不稳定,极易转化为SO3 |
下列离子方程式书写正确的是( )
| A、在硫氢化钠溶液中加入稀硫酸溶液:S2-+2H+→H2S↑ |
| B、用氢氧化钠溶液除去镁粉中的铝粉:2Al+2OH-→AlO2-+H2↑ |
| C、向碳酸氢钠溶液中加入少量氢氧化钙溶液:2HCO3-+Ca2++2OH-→CaCO3↓+CO32-+2H2O |
| D、偏铝酸钠溶液中通入少量二氧化碳:2AlO2-+CO2+3H2O→2Al(OH)3↓+CO32- |
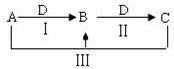 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图(部分反应中的水已略去).