题目内容
在标准状况下,某气态烃的密度是1.34g?L-1,一定体积的该烃充分燃烧后生成 CO213.2g,同时生成H2O 8.1g,求此烃的分子式.
考点:有关有机物分子式确定的计算
专题:烃及其衍生物的燃烧规律
分析:根据M=ρVm计算气态烃的摩尔质量,根据n=
计算二氧化碳、水的物质的量,再根据原子守恒确定气态烃最简式,结合相对分子质量确定分子式.
| m |
| M |
解答:
解:在标准状况下,某气态烃的密度是1.34g?L-1,则气态烃的摩尔质量=1.34g/L×22.4L/mol=30g/mol,即该烃的相对分子质量为30,
一定体积的该烃充分燃烧后生成 CO213.2g,同时生成H2O 8.1g,根据原子守恒,则烃中C、H原子数目之比=
:
×2=1:3,则该烃的最简式为CH3,令烃的分子式为(CH3)x,则15x=30,故x=2,则烃的分子式为C2H6,
答:烃的分子式为C2H6.
一定体积的该烃充分燃烧后生成 CO213.2g,同时生成H2O 8.1g,根据原子守恒,则烃中C、H原子数目之比=
| 13.2g |
| 44g/mol |
| 8.1g |
| 18g/mol |
答:烃的分子式为C2H6.
点评:本题考查有机物分子式的确定,难度不大,注意利用原子守恒确定最简式,再结合相对分子质量计算.

练习册系列答案
相关题目
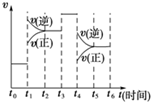 反应N2(g)+3H2(g)
反应N2(g)+3H2(g)
| ||
| △ |
| A、t0~t1 |
| B、t2~t3 |
| C、t3~t4 |
| D、t5~t6 |

 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,来制备甲醇.
