题目内容
 甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,来制备甲醇.
甲醇被称为2l世纪的新型燃料,工业上通过下列反应Ⅰ和Ⅱ,来制备甲醇.(1)将1.0mol CH4和2.0mol H2O(g)通入反应室(容积为100L),
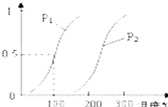
在一定条件下发生反应:CH4(g)+H2O(g)?CO(g)+3H2(g)Ⅰ,CH4的转化率与温度、压强的关系如图所示:
①已知100℃时达到平衡所需的时间为5min,则用H2表示的平均反应速率为
②图中的P1
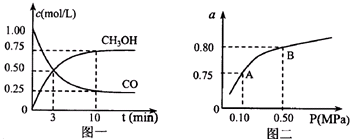
(2)在压强为0.1MPa条件下,a mol CO与3a mol H2的混合气体在催化剂作用下能自发反应生成甲醇:CO(g)+2H2(g)?CH3OH(g)
③该反应的△H
④若容器容积不变,下列措施可增加甲醇产率的是
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
(3)在最新开发并投入生产的流动电解质直接甲醇燃料电池中,流动电解质硫酸的使用,可提高燃料电池效率约30%,该电池的负极反应为
考点:化学平衡的影响因素,化学电源新型电池,反应速率的定量表示方法
专题:基本概念与基本理论
分析:(1)①①根据图知道平衡时甲烷的转化率,求出△c(CH4),根据v=
计算v(CH4),利用速率之比等于化学计量数之比计算v(H2);
②根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;
(2)③根据△G=△H-T?△S进行判断,如△G<0,则反应能自发进行,如△G>0,则不能自发进行;
④增加甲醇产率,应改变条件使平衡向正反应方向移动,根据平衡移动原理分析解答;
(3)根据原电池中负极发生氧化反应,正极发生还原反应,并考虑电解质溶液参与电极反应来分析.
| △c |
| △t |
②根据定一议二原则,定温度同,再比较压强,即作垂直x轴的辅助线,比较平衡时甲烷的转化率,由此判断;
(2)③根据△G=△H-T?△S进行判断,如△G<0,则反应能自发进行,如△G>0,则不能自发进行;
④增加甲醇产率,应改变条件使平衡向正反应方向移动,根据平衡移动原理分析解答;
(3)根据原电池中负极发生氧化反应,正极发生还原反应,并考虑电解质溶液参与电极反应来分析.
解答:
解:(1)由100℃平衡CH4的转化率为0.5可知,消耗CH4为1mol×0.5=0.5mol,平衡时甲烷的浓度变化量为:
=5×10-3mol/L,根据甲烷与氢气的计量数关系,则:v(H2)=3v(CH4)=3×
=0.0030mol?L-1?min-1,
故答案为:0.0030mol?L-1?min-1;
②由图可知温度相同时,到达平衡时,压强为P1的CH4转化率高,正反应为气体体积增大的反应,增大压强平衡向逆反应方向移动,甲烷的转化率降低,故压强P1<P2,
故答案为:<;
(2)③该反应正反应是气体物质的量减小的反应,气体的物质的量越多,其熵越大,所以△S<0,混合气体在催化剂作用下能自发反应生成甲醇,则应该满足:△G=△H-T?△S<0,由于△S<0,则△H<0,
故答案为:<;
④增加甲醇产率,应改变条件使平衡向正反应方向移动,
A.正反应为放热反应,升高温度,平衡向逆反应方向移动,甲醇的产率减小,故A错误;
B.将CH3OH(g)从体系中分离,降低生成物的浓度,平衡向正反应方向移动,甲醇的产率增大,故B正确;
C.充入He,使体系总压强增大,容器的容积不变,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;
D.再充入1mol CO和3mol H2,可以等效为增大压强,平衡向体积减小的正反应方向移动,甲醇的产率增大,故D正确,
故答案为:BD;
(3)由燃料电池是原电池的一种,负极失电子发生氧化反应,正极得电子发生还原反应,甲醇燃烧生成二氧化碳和水,
但在酸性介质中,正极不会生成大量氢离子,则电解质参与电极反应,甲醇燃料电池的负极反应式为:CH3OH+H2O-6e-=CO2+6H+,
正极反应式为:
O2+6H++6e-=3H2O,
故答案为:CH3OH+H2O-6e-=CO2+6H+.
| 0.5mol |
| 100L |
| 5×10-3mol/L |
| 5min |
故答案为:0.0030mol?L-1?min-1;
②由图可知温度相同时,到达平衡时,压强为P1的CH4转化率高,正反应为气体体积增大的反应,增大压强平衡向逆反应方向移动,甲烷的转化率降低,故压强P1<P2,
故答案为:<;
(2)③该反应正反应是气体物质的量减小的反应,气体的物质的量越多,其熵越大,所以△S<0,混合气体在催化剂作用下能自发反应生成甲醇,则应该满足:△G=△H-T?△S<0,由于△S<0,则△H<0,
故答案为:<;
④增加甲醇产率,应改变条件使平衡向正反应方向移动,
A.正反应为放热反应,升高温度,平衡向逆反应方向移动,甲醇的产率减小,故A错误;
B.将CH3OH(g)从体系中分离,降低生成物的浓度,平衡向正反应方向移动,甲醇的产率增大,故B正确;
C.充入He,使体系总压强增大,容器的容积不变,反应混合物各组分浓度不变,平衡不移动,甲醇的产率不变,故C错误;
D.再充入1mol CO和3mol H2,可以等效为增大压强,平衡向体积减小的正反应方向移动,甲醇的产率增大,故D正确,
故答案为:BD;
(3)由燃料电池是原电池的一种,负极失电子发生氧化反应,正极得电子发生还原反应,甲醇燃烧生成二氧化碳和水,
但在酸性介质中,正极不会生成大量氢离子,则电解质参与电极反应,甲醇燃料电池的负极反应式为:CH3OH+H2O-6e-=CO2+6H+,
正极反应式为:
| 3 |
| 2 |
故答案为:CH3OH+H2O-6e-=CO2+6H+.
点评:本题考查化学反应速率、平衡常数、化学平衡计算、化学平衡的影响因素及读图能力、原电池工作原理等,综合性较大,题目难度中等,知识面广,应加强平时知识的积累,注意控制变量法与定一议二原则应用.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
物质的量浓度、体积都相同的一元酸和一元碱恰好中和时,溶液将( )
| A、显酸性 | B、显中性 |
| C、显碱性 | D、无法确定酸碱性 |

 (1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是
(1)事实证明,能设计成原电池的反应通常是放热反应,下列化学反应在理论上可以设计成原电池的是