题目内容
三氟化氮(NF3)是一种无色、无臭的气体,在潮湿的空气中能与水蒸气反应,产物有NO、HNO3和HF.下列说法错误的是( )
| A、反应中被氧化与被还原的元素,其原子的物质的量之比为1:2 |
| B、NF3与NH3化学性质的不同是因F与H两元素非金属性的差异引起 |
| C、NF3一旦泄漏,可用NaOH溶液喷淋,只有NaF、NaNO3和H2O产生 |
| D、若反应中转移0.2mol电子,则生成的NO气体体积约为4.48L(标准状况) |
考点:氧化还原反应,氯、溴、碘及其化合物的综合应用
专题:氧化还原反应专题,卤族元素
分析:NF3与H2O的反应的方程式为3NF3+5H2O(g)=9HF+2NO+HNO3该反应中氧化剂、还原剂都是NF3,氧化产物是NO,结合元素化合价的变化与得失电子的关系解答.
解答:
解:A.3NF3+5H2O(g)=9HF+2NO+HNO3该反应中被氧化元素是氮元素,被还原的元素是氮元素,依据元素化合价变化计算得到,被氧化与被还原的元素的物质的量之比为1:2,故A正确;
B.NF3中N元素化合价为+3价,NH3中N元素化合价为-3价,原因是非金属性F>N>H,导致N元素化合价不同,故B正确;
C.NF3与H2O的反应的方程式为3NF3+5H2O(g)=9HF+2NO+HNO3,则与NaOH反应时,有NaF、NaNO3、H2O和NO生成,故C错误;
D.由反应可知,生成1molNO转移1mol电子,则若反应中转移的电子0.2mol,则生成4.48LNO气体(标况),故D正确.
故选C.
B.NF3中N元素化合价为+3价,NH3中N元素化合价为-3价,原因是非金属性F>N>H,导致N元素化合价不同,故B正确;
C.NF3与H2O的反应的方程式为3NF3+5H2O(g)=9HF+2NO+HNO3,则与NaOH反应时,有NaF、NaNO3、H2O和NO生成,故C错误;
D.由反应可知,生成1molNO转移1mol电子,则若反应中转移的电子0.2mol,则生成4.48LNO气体(标况),故D正确.
故选C.
点评:本题考查氧化还原反应,侧重氧化还原反应中基本概念的考查,把握反应中元素的化合价变化为解答的关键,注意利用习题中的信息及知识迁移即可解答,题目难度不大.

练习册系列答案
相关题目
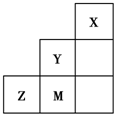
如图为元素周期表中短周期的一部分,关于推断Y、Z、M的说法正确的是( )
 ??
??
 ??
??| A、非金属性:Y>Z>M |
| B、离子半径:M->Z2->Y- |
| C、Z元素最高价氧化物的对应水化物的浓溶液具有强氧化性和不挥发性 |
| D、三种元素中,Y的最高价氧化物对应的水化物酸性最强 |
下列电池中不属于二次电池的是( )
| A、碱性锌锰电池 | B、铅蓄电池 |
| C、镍镉电池 | D、锂离子电池 |
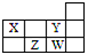 四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )
四种短周期元素在周期表中的相对位置如图所示,下列说法错误的是( )| A、X和Y元素的原子最外层电子数之和等于Z元素的原子最外层电子数的2倍 |
| B、Y元素的非金属性强于W元素的,其最高价氧化物水化物的酸性也强于W的 |
| C、X最简单氢化物溶于水呈碱性,Z最简单氢化物溶于水呈酸性 |
| D、W元素形成的单质可以从Z元素氢化物的水溶液中置换出Z单质 |
NA为阿伏加德罗常数,下列说法正确的是( )
| A、标准状况下,5.6L氯气和16.8L氧气的混合气体中含有分子数为NA |
| B、标准状况下,22.4L H2O所含有原子数为3NA |
| C、NA个N2分子所占的体积与0.5NA个H2分子所占的体积比一定是2:1 |
| D、1mol/L NaCl溶液含有2NA个氯离子 |
已知A、B、C、D、E是短周期中原子序数依次增大的5种主族元素,其中A的原子最外层电子数是次外层电子数的2倍,元素B的原子最外层电子数是其电子层数的3倍,D与A为同主族元素,元素C与E形成的化合物CE是厨房常用调味品.下列说法正确的是( )
| A、原子半径:C>D>B>A |
| B、A、D、E最高价氧化物对应水化物酸性增强 |
| C、只含B元素的物质一定是纯净物 |
| D、化合物C2AB3的水溶液显碱性,可用于洗去铜片表面的油污 |
X、Y、Z、W是短周期元素,X为地壳中含量最高的金属元素;Y原子最外层电子数是电子总数的
;Z的最高正化合价与最低负化合价的代数和为4;W原子在短周期中原子半径最大.下列说法正确的是( )
| 2 |
| 3 |
| A、ZO3和水反应形成的化合物是离子化合物 |
| B、粘在试管内壁上的Z可以用YZ2洗涤 |
| C、最高价氧化物对应水化物的碱性:X>W |
| D、X位于金属与非金属的分界线处,常用来做半导体材料 |