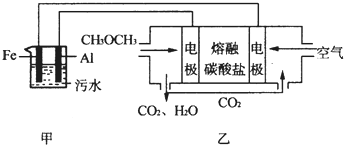
��Ŀ����
1���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���壮��1��һ�������£���2molNO��2molO2���ں����ܱ������з�����Ӧ2NO��g��+O2��g��?2NO2��g�������и�����˵����Ӧ�ﵽƽ��״̬����abc��
a����ϵѹǿ���ֲ���
b�����������ɫ���ֲ���
c��NO��O2�����ʵ���֮�ȱ��ֲ���
d��ÿ����1molO2ͬʱ����2molNO2
��2��CO�����ںϳɼ״���һ���¶��£������Ϊ2L���ܱ������м���CO��H2��������ӦCO��g��+2H2��g��?CH3OH��g������ƽ����ø����Ũ�����£�
| ���� | CO | H2 | CH3OH |
| Ũ�ȣ�mol•L-1�� | 0.9 | 1.0 | 0.6 |
���������¶ȣ�Kֵ������Ӧ�ġ�H��0���������������
��������������䣬�ٳ���0.6molCO��0.4molCH3OH����ʱv��=v�������������������=����
���� ��1�����淴Ӧ����ƽ��ʱ��ͬ�����ʵ�������������ұ��ֲ��䣬����ֵ�Ũ�ȡ��������ֲ��䣬�ɴ�����������һЩ�����䣬�ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����ٱ仯˵������ƽ�⣻
��2���ٸ���K=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$����ƽ�ⳣ����
�ڽ����¶ȣ�Kֵ����˵�������¶�ƽ���������ƶ��������Ƿ��ȷ�Ӧ��
�ۼ���Ũ����Qc����Qc=K������ƽ��״̬����Qc��K����Ӧ������Ӧ���У���Qc��K����Ӧ���淴Ӧ���У������ж�v����v����Դ�С��
��� �⣺��1��a���÷�Ӧ���ߵĻ�ѧ����������ȣ��ڷ�Ӧû�дﵽƽ��ʱ����������ʵ����ᷢ���ı䣬��ϵ��ѹǿҲҪ�ı䣬���ѹǿ����˵����������ɺ�����������ȣ���Ӧ�ﵽ��ƽ�⣬��a��ȷ��
b����Ӧ��NO2����ɫ���壬��ɫ����˵��NO2��Ũ�Ȳ��ٸı䣬��Ӧ�ﵽ��ƽ�⣬��b��ȷ��
c��NO��O2����ʼ���ʵ�����ȣ�����ѧ��������ͬ���仯���Ͳ���ͬ�����û�дﵽƽ�⣬NO��O2 �����ʵ���֮�Ȼᷢ���ı䣬�������ı�˵��������ƽ�⣬��c��ȷ��
d�� O2 �Ƿ�Ӧ�NO2��������������κ�ʱ����ÿ����1 molO2ͬʱ����2 molNO2����d����
��ѡ��abc��
��2����ƽ�ⳣ��K=$\frac{c��C{H}_{3}OH��}{c��CO����{c}^{2}��{H}_{2}��}$=$\frac{0.6}{0.9��{1}^{2}}$=$\frac{2}{3}$���ʴ�Ϊ��$\frac{2}{3}$��
�ڽ����¶ȣ�Kֵ����˵�������¶�ƽ���������ƶ��������Ƿ��ȷ�Ӧ���ʡ�H��0���ʴ�Ϊ������
��Ũ����Qc=$\frac{0.6+\frac{0.4}{2}}{��0.9+\frac{0.6}{2}����{1}^{2}}$=$\frac{2}{3}$=K������ƽ��״̬����v��=v�����ʴ�Ϊ��=��
���� ���⿼�黯ѧƽ��״̬���жϡ�ƽ�ⳣ���ļ�����Ӧ�õȣ�ע���ж�ƽ���������Ӧ�淴Ӧ���з����仯�����������ɱ仯�����ٱ仯˵������ƽ�⣮

| A�� | Al��[Al��OH��4]- | B�� | Na2CO3��NaOH | C�� | Al2O3��Al��OH��3 | D�� | Fe��OH��2��Fe��OH��3 |
| A�� | ���ȶ��ԣ�Na2CO3��NaHCO3 | B�� | ���ԣ�H2CO3��H2SiO3 | ||
| C�� | ���ԣ�NaOH��LiOH | D�� | ���ȶ��ԣ�HF��HBr |
| A�� | ���õ������CeO2��ȡ�����棬������������ | |
| B�� | 58138Ce��58142Ce��ͬ�������� | |
| C�� | ��������HI��Һ��������Ӧ�����ӷ���ʽΪ��Ce+4H+�TCe4++2H2 | |
| D�� | ���ԭ�Ӻ�����58������ |
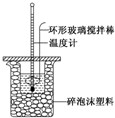 ijʵ��С����0.50mol•L-1 NaOH��Һ��0.50mol•L-1 ������Һ���з�Ӧ�ȵIJⶨ��ʵ��װ����ͼ��ʾ��
ijʵ��С����0.50mol•L-1 NaOH��Һ��0.50mol•L-1 ������Һ���з�Ӧ�ȵIJⶨ��ʵ��װ����ͼ��ʾ����1��д���÷�Ӧ���Ȼ�ѧ����ʽ����1mol H2O��l��ʱ�ķ�Ӧ��Ϊ-57.3kJ•mol-1$\frac{1}{2}$H2SO4��aq��+NaOH��aq���T$\frac{1}{2}$Na2SO4��aq��+H2O��l����H=-57.3 kJ•mol-1��
��2��ȡ50mL NaOH��Һ��30mL������Һ����ʵ�飬ʵ�����������ʾ��
| �¶� ���� | ��ʼ�¶�t1/�� | ��ֹ�� ��t2/�� | �¶Ȳ� ƽ��ֵ ��t2-t1��/�� | ||
| H2SO4 | NaOH | ƽ��ֵ | |||
| 1 | 26.2 | 26.0 | 26.1 | 30.1 | |
| 2 | 27.0 | 27.4 | 27.2 | 33.3 | |
| 3 | 25.9 | 25.9 | 25.9 | 29.8 | |
| 4 | 26.4 | 26.2 | 26.3 | 30.4 | |
������ʵ����ֵ�����-57.3kJ•mol-1��ƫ�����ƫ���ԭ�����ǣ�����ĸ��b��
a��ʵ��װ�ñ��¡�����Ч����
b����ȡNaOH��Һ�����ʱ���Ӷ���
c���ֶ�ΰ�NaOH��Һ����ʢ�������С�ձ���
d�����¶ȼƲⶨNaOH��Һ��ʼ�¶Ⱥ�ֱ�ӲⶨH2SO4��Һ���¶�
��3������һ������ϡ����������Һ��ϡ����������Һ��ϡ��ˮ�ֱ��1L 1mol•L-1 ��ϡ����ǡ����ȫ��Ӧ���䷴Ӧ�ȷֱ�Ϊ��H1����H2����H3�����H1����H2����H3�Ĵ�С��ϵΪ��H1=��H2����H3����
| A�� |  ��ȡʱ��Һ©�� | B�� |  ��⾫��ͭ | ||
| C�� |  ���ȷ�Ӧ | D�� |  ʵ����ģ��ϳɰ� |
| A�� | Mg��OH��2[Al��OH��3] | B�� | MgCl2��AlCl3�� | C�� | Mg��Al�� | D�� | MgO��Al2O3�� |